-
开放科学(资源服务)标识码(OSID):

-
水稻作为全球最重要的粮食作物之一,持续提高产量对保障粮食安全具有重要意义。近年来,耕地面积的持续缩减与极端气候事件的频发,对水稻产量的提升构成了严峻挑战,如何更有效地提高水稻产量成为育种工作者亟待解决的首要任务[1]。水稻产量3要素由有效穗数、每穗粒数及粒质量构成,而粒型是决定粒质量进而影响水稻产量的重要因素[2-3],因此,分离和克隆粒型相关基因可为水稻高产育种提供重要资源。
水稻粒型由粒长、粒宽和长宽比决定,是由多个基因调控的数量性状[4]。目前已克隆多个粒型调控基因。GS3是水稻中首个被克隆的粒长QTL,也是目前应用最多的一个粒长基因[5-6]。GS3编码异三聚体G蛋白γ亚基,是控制水稻粒质量和粒长的主效QTL,对粒长起负调控作用[7]。qGL3编码一个蛋白磷酸酶PPKL家族的丝氨酸/苏氨酸磷酸酶,参与调控细胞周期蛋白、细胞分裂素和油菜素内酯等途径,负调控水稻粒长[8]。GL3.1编码一个丝氨酸/苏氨酸磷酸酶,该激酶对水稻粒长起负调控作用,GL3.1能直接去磷酸化底物T1;3(细胞周期蛋白),而T1;3表达下调会导致籽粒变短[9-11]。LGY3是E型MADS盒基因OsMADS1,其可变剪接蛋白OsMADS1lgy3产生细长粒,提高稻谷的品质和产量[12]。GW2编码一种RING型E3泛素连接酶,具有负调节细胞分裂的功能,GW2功能缺失能显著增加粒质量[13]。GS5编码一个丝氨酸羧肽酶,具有正调控籽粒大小的功能,其表达量升高可使籽粒增大[14-15]。OsUBP15具有去泛素化活性,通过增加水稻颖壳横向细胞数量参与粒宽调节[16]。WTG1基因编码一个otubain-like蛋白酶,是一个去泛素化酶,WTG1促进IPA1的K48多泛素化被26S-蛋白酶体降解,并抑制IPA1的K36多泛素化,其功能缺失导致突变体籽粒的粒宽、粒厚发生改变[17-18]。GL2/GS2编码生长调节因子OsGRF4,通过促进小穗颖壳中细胞的生命周期,从而影响生长分裂来调节籽粒大小[19-20]。GW7编码TONNEAU1募集基序蛋白,可正向调控颖壳纵向细胞的分裂并缩短横向细胞的分裂[21]。TGW3编码一个类似糖原合酶GSK3的激酶,是粒长和粒质量的负调控因子,能协同改变颖壳中细胞的大小和数量,从而调控籽粒的大小发育[22]。
遗传变异产生的途径主要包括自然变异和人工诱变两种。人工诱变产生的突变体表型通常是由于相关基因功能完全缺失,往往产生不利突变,且突变产生的功能缺失远多于基因修饰。相较于人工诱变,自然变异在遗传改良中展现出显著的优势:①其变异特征多表现为由QTL调控的数量性状;②产生的表型变异不仅是等位基因功能的存在或缺失,还可能来自弱效等位基因的调控差异;③该途径可在保留基因功能完整性的前提下进行功能解析;④自然变异体系能够解析微效基因对表型的累积效应,为复杂性状的遗传解析提供独特视角[23-25]。染色体片段代换系(chromosome segment substitution lines,CSSL)作为创造丰富自然变异的理想材料,其特征是将野生或远缘种导入栽培品种的优良遗传基因库中,每个CSSL在受体基因组的背景下保留1个或少数供体亲本来源的染色体代换片段。当只导入唯一代换片段时,则定义为单片段代换系(single segment substitution lines,SSSL)。这类SSSL因其遗传背景与受体亲本高度一致仅存在代换片段差异,可有效消除遗传背景的干扰,作为次级作图群体可更精确分析QTL[26]。已有研究利用水稻CSSL鉴定了一些重要性状的QTL,发掘了其中的等位基因变异,并分析了QTL之间及QTL与环境之间的互作,同时还对一些重要基因进行了克隆及功能分析。染色体片段代换系鉴定的基因可直接应用于生产实践,使遗传研究与育种紧密相连,因此可作为设计育种的理想材料。张桂权[27]通过SSSL设计出了华小黑1号(粤审稻2005015)、华标1号(粤审稻2009033)等黑米优质品种,并利用恢复力最强的Rf3-4和Rf4-4等位基因,育成了具有强恢复力的HJX74恢复系,研究表明目标染色体代换是水稻设计育种的一种方法。
水稻粒型作为一个典型的数量性状,其遗传机理十分复杂,目前虽然已经克隆了一定的粒型调控基因,但仍不足以揭示粒型的遗传多样性和分子调控网络。本研究鉴定到1个携带18个代换片段、具有大粒表型的水稻染色体片段代换系Z255。对Z255进行农艺性状的测量与细胞学分析、粒型发育相关基因的表达分析、粒型QTL定位及次级代换系片段选育,研究结果有助于系统解析粒型调控网络,为多基因聚合育种提供新策略,同时也为水稻籽粒性状改良提供宝贵的种质资源。
HTML
-
大粒染色体片段代换系Z255是以粳稻品种日本晴作为受体亲本、籼稻恢复系R225为供体亲本,通过多代回交与自交结合SSR分子标记辅助选育出的含18个代换片段的染色体片段代换系。以日本晴/Z255构建的次级F2代群体作为QTL定位材料。
通过QTL定位的结果,在日本晴和Z255杂交产生的F2代群体中根据基因型与表型选择含有目标QTL的单株进行种植,将其发展成F3代群体,利用MAS法筛选出次级单片段或多片段代换系。
-
利用水稻基因组均匀分布的429个SSR标记对日本晴和R225进行多态性分析[28];利用筛选出的253个多态性标记从BC2F1代开始进行分子辅助选择,从BC2F1代中选择20株单株进行自交,然后从每个株系的每代各取10株继续通过多态性分子标记进行辅助选择[29];通过多态性分子标记在日本晴/BC2F4自交的F7代中选育出含18个水稻染色体代换片段的水稻大粒CSSL-Z255。参考Zhou等[30]描述的方法,对代换的水稻染色体片段进行鉴定,代换片段长度参照Paterson等[31]的方法进行计算。
-
2019年于西南大学水稻研究所歇马实验基地种植日本晴与Z255并通过杂交产生F1代杂交种,于同年10月在海南基地种植收获F2代种子;次年3月初于歇马实验基地将日本晴、Z255以及F2代群体的种子进行播种,4月中旬后进行试验田规划,以株距16.60 cm和行距26.50 cm移栽日本晴与Z255各30株及148株F2代单株至同一块试验田并进行常规种植管理;2021年4月,以相同的规格和管理方式在西南大学水稻研究所歇马实验基地将日本晴、Z255和从F2代群体中选出的目标株系进行单株育苗及次级代换片段的选育。
-
于成熟期随机选取日本晴10粒、Z255 10粒及F2代群体148粒,对其粒长、粒宽、长宽比、千粒质量进行测量统计,并计算平均值、标准差及F2代群体的偏度和峰度。
-
使用Excel 2019对所有数据进行统计分析,利用SPSS 26软件进行显著性检验,采用t检验对两个处理进行差异性分析,p<0.05为差异有统计学意义。多重比较采用HSD检验的单因素方差分析。
-
通过日本晴和Z255杂交创建的148个单株组成的次级F2代群体作为QTL定位群体,使用CTAB法提取日本晴、Z255及148个F2代单株的DNA[32],利用Z255代换片段中的多态性SSR标记为引物进行PCR扩增,采用非变性聚丙烯酰胺凝胶电泳和DNA银染法显色,在进行基因型赋值时将日本晴带型标记为“A”、Z255带型标记为“B”、杂合带型标记为“H”、缺失带型标记为“0”。根据F2代148个单株的基因型赋予值与对应的表型值,在SAS统计软件上定位QTL并采用HPMIXED程序的限制性最大似然法,以p<0.05为阈值决定一个QTL能否与染色体代换片段上的某标记进行连锁[33-34]。
-
通过QTL定位的结果,在日本晴和Z255杂交产生的F2代群体中根据基因型与表型选择含有目标QTL的单株进行种植,利用MAS法对其中的杂合标记进行筛选,进一步筛选出不含杂合标记的次级片段代换系。
-
取日本晴和Z255抽穗期相同部位的水稻颖壳,利用Hitachi SU3800扫描电镜对水稻颖壳进行观察并拍照[16]。
-
取抽穗期同一部位的日本晴和Z255水稻颖壳,在FAA固定液(45%乙醇、5%冰乙酸和4.8%甲醛)中重复抽真空至样品沉于底部,4 ℃条件下固定过夜。对样品进行脱水、包埋和切片,切片染色烘干后利用Nikon Eclipse E600显微镜观察并拍照记录[34]。
-
取日本晴与Z255相同孕穗期的幼嫩小穗提取RNA,合成cDNA第一链进行实时荧光定量PCR。根据相关基因的编码序列设计qRT-PCR特异性引物(表 1),以Actin(Os03g0718100) 为内参基因进行实时荧光定量分析。每个样品设置3个重复,使用荧光定量PCR仪进行检测,对所得Ct值进行分析,通过t检验或者HSD检验差异的显著性。
1.1. 试验材料
1.2. 水稻大粒CSSL-Z255培育及代换片段鉴定
1.3. 材料种植方法
1.4. 表型分析和农艺性状统计
1.5. 统计分析方法
1.6. QTL定位
1.7. 次级代换片段系选育
1.8. 扫描电镜观察
1.9. 石蜡切片
1.10. RNA的提取与qRT-PCR
-
以Z255代换片段上的多态性SSR标记RM5864、RM6266、RM5626等作为引物,提取受体日本晴、优良长粒籼稻恢复系R225及10株Z255叶片的DNA进行代换片段基因型鉴定,结果表明,10株Z255的代换片段标记带型一致,表明Z255代换片段准确。Z255在日本晴的遗传背景下含有来自R225的共18个代换片段,其总代换长度为59.9 Mb,最大长度为7.8 Mb,最短长度为0.7 Mb,平均长度为3.33 Mb。粒型相关的代换片段有6个,分布于第2、3、4、8、12染色体上(图 1),总代换长度为28.6 Mb,最大长度为7.8 Mb,最短长度为0.8 Mb,平均代换长度为4.77 Mb。
-
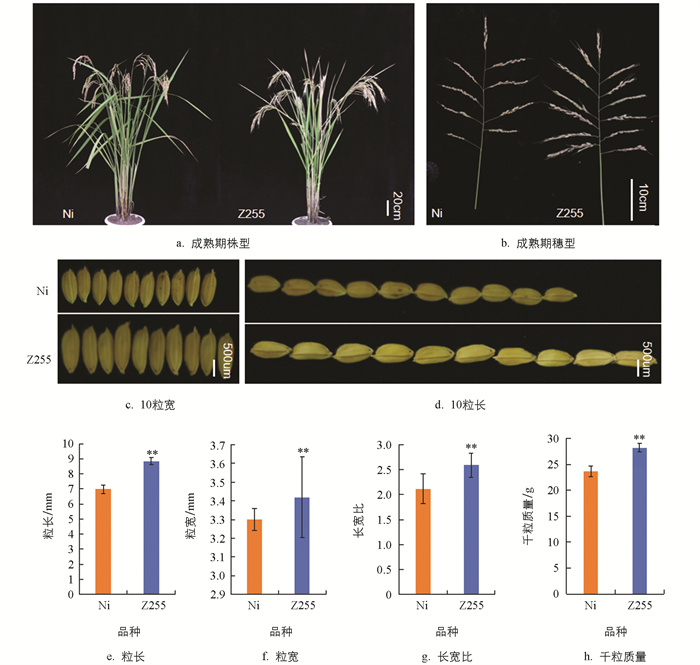
与受体亲本日本晴(Ni)相比,Z255株型、穗型无显著变化(图 2a、2b),Z255的粒长极显著增加了26.79%(图 2d、2e),粒宽极显著增加了3.60%(图 2c、2f),长宽比极显著增加了22.34%(图 2g),千粒质量极显著增加了19.43%(图 2h),因此,与日本晴相比,Z255表现出大粒表型,具有重要的育种价值。
-
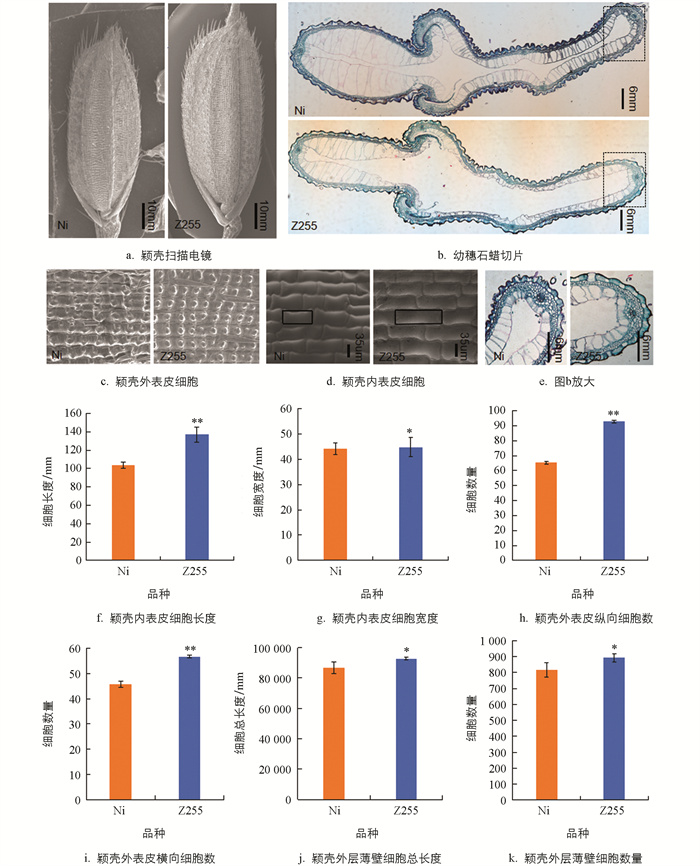
利用扫描电镜对Z255及日本晴抽穗期颖壳相同中间部位内外表面的细胞形态进行观察(图 3),结果发现,Z255颖壳内表皮细胞长度相比于日本晴极显著增加了32.51%(图 3a、3d、3f),内表皮细胞宽度增加了1.59%(图 3d、3g);Z255颖壳外表皮单位面积细胞数量显著增加(图 3c),且最长处纵向和最宽处横向的细胞数目均显著高于日本晴(图 3a、3h、3i)。这些研究表明Z255的籽粒增大是由于颖壳细胞长度和宽度增大以及细胞的数量增加所致。
为进一步分析Z255籽粒形态变化的原因,在抽穗期同一时期取Z255和日本晴相同部位的幼嫩小穗进行石蜡切片,结果表明,Z255的颖壳外层薄壁组织细胞总长度相较于日本晴增加了8.11%(图 3b、3e、3j),同时其薄壁细胞数量也表现为显著增加(图 3b、3e、3k)。结果进一步表明,Z255颖壳细胞大小和数量的增多是引起其籽粒增大的主要因素。
-
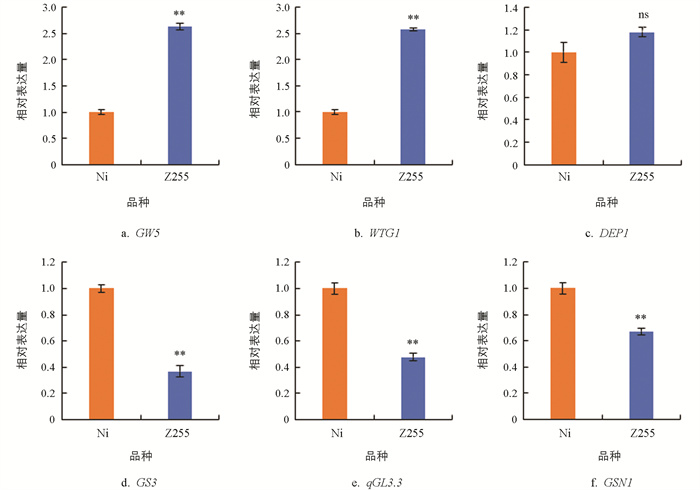
由图 4可知,与日本晴相比,Z255幼穗中正调控粒长基因GW5、WTG1的表达量显著升高(图 4a、4b),DEP1的表达量升高但差异无统计学意义(图 4c),而负调控粒长基因GS3、qGL3.3、GSN1的表达量显著降低(图 4d、4e、4f)。另外,GW5和WTG1都对粒宽起着负向调节的作用,在Z255的幼穗中,它们的表达量显著升高(图 4a、4b)。结果表明,Z255籽粒的长度和宽度的改变很可能与相关基因的表达量有关。
-
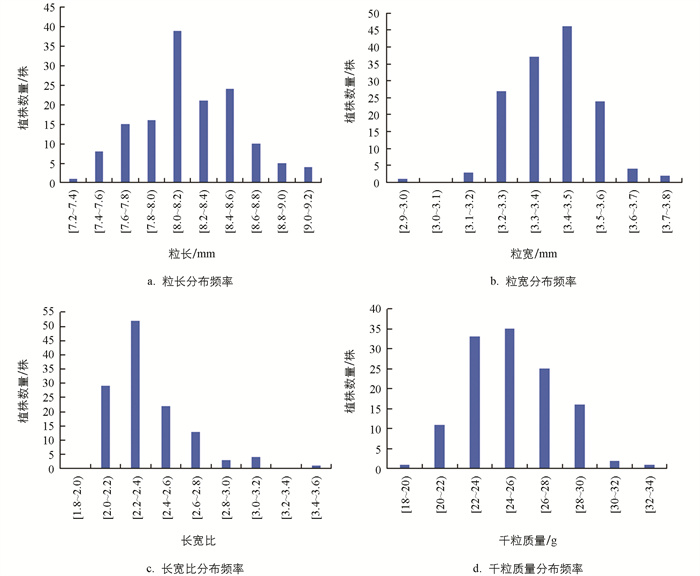
对F1代籽粒形态进行观察,发现Z255的大粒相对小粒呈显性遗传。在日本晴和Z255的次级F2代群体中,长粒主要分布在8.0~8.6 mm,短粒主要分布在7.2~8.0 mm(图 5a);宽粒主要分布在3.0~3.3 mm,窄粒主要分布在3.3~3.7 mm(图 5b);长宽比主要分布于2.0~2.6(图 5c);千粒质量主要分布于22~28 g(图 5d),不满足卡方3∶1的分离比,且具有双峰分布,说明这些性状是连续分布(图 5),且粒长、粒宽、长宽比、千粒质量的偏度均不为0,呈一定的负偏态或正偏态,峰度均不为3(表 2)。综上所述,粒长、粒宽、长宽比、千粒质量均由多个基因控制。
-
以日本晴/Z255构建的次级F2代群体中,共鉴定出11个控制粒型的QTL,包括控制粒长(4个)、粒宽(2个)、长宽比(3个)和千粒质量(2个)表型(表 3)。粒长由1个主效QTL(qGL-3)和3个微效QTL(qGL-4、qGL-8、qGL-12)控制,其加性效应分别使粒长增加0.20 mm、0.09 mm、0.09 mm和减少0.09 mm,对粒长变异的贡献率分别为32.65%、7.03%、5.89%和5.77%。粒宽由2个微效QTL(qGW-2、qGW-8)控制,其加性效应使粒宽分别减少0.03 mm和增加0.02 mm,对粒宽变异的贡献率分别为4.72%和2.34%。长宽比由1个主效QTL(qRLW-3)和2个微效QTL(qRLW-2、qRLW-8)控制,对表型变异的贡献率分别为31.87%、2.45%和7.92%。千粒质量由2个微效QTL(qGWT-3、qGWT-4)控制,对表型变异的贡献率分别为4.54%和2.68%(表 3)。
粒长中的3个QTL、粒宽中的1个QTL和长宽比中的2个QTL属于正向加性效应,因此,Z255的大粒可能由粒长、粒宽和长宽比增加所致。此外,qGL-3、qRLW-3、qGWT-3共同连锁于分子标记RM6266,可能属于一因多效或QTL紧密连锁(表 3)。
-
使用MAS法在F3代中选出了21个包含以上11个粒型相关QTL的次级片段代换系,分别为单片段代换系2个(S1-S2),双片段代换系9个(D1-D9)、三片段代换系8个(T1-T8)、四片段代换系1个(FS1)和五片段代换系1个(QS1)。S1和S2两个单片段代换系中的粒型相关QTL qGL-3、qRLW-3、qGWT-3重复检测到5次,qRLW-8检测到7次(表 4)。
2.1. Z255代换片段的鉴定
2.2. 日本晴和Z255的表型鉴定
2.3. 细胞学分析
2.4. Z255粒型相关基因的RT-qPCR分析
2.5. 粒型性状在日本晴/Z255的次级F2代群体中的频率分布
2.6. 基于日本晴/Z255的次级F2代群体的粒型QTL鉴定
2.7. 次级染色体片段代换系的选育
-
粒型由粒长、粒宽和长宽比决定,对产量3要素产生重要影响。目前研究表明,粒型基因主要通过调控颖壳细胞大小和细胞数目,从而决定籽粒大小[4]。GW6a编码一种新型的类GNAT蛋白OsglHAT1,该基因通过增加籽粒颖壳细胞数量正向调控水稻籽粒的质量和产量[35]。XIAO基因预测编码一个富含亮氨酸重复序列(LRR)的激酶,xiao突变体籽粒短小是由于颖壳细胞数量减少所致[36]。LG1编码一种组成型表达的泛素特异性蛋白酶15(OsUBP15),该基因通过影响颖壳细胞的增殖来调控籽粒宽度[37]。GLW7编码一种SQUAMOSA启动子结合蛋白样蛋白13(OsSPL13),该基因有利于颖壳细胞增大,从而改善籽粒长度[38]。PGL1/PGL2基因通过控制颖壳细胞的长度来决定水稻籽粒的长度[39]。此外,同时调控颖壳细胞增殖与扩张的基因也与籽粒大小相关。BG1编码一种植物特异性蛋白,通过同时控制细胞数量和细胞面积来正向调控籽粒大小[40]。GS5同样通过影响细胞大小和细胞数量,起到正向调控籽粒大小的作用[14]。本研究鉴定到的大粒染色体片段代换系Z255,与受体亲本日本晴相比,籽粒极显著增大。组织学分析结果发现,Z255籽粒增大是由于颖壳细胞大小以及细胞数量增多引起,因此,Z255在细胞学层面上与以上大部分粒型基因一致,均通过调控细胞增殖与细胞大小来影响籽粒大小,可能与已知粒型基因处于同一通路。
-
水稻粒型作为影响产量和品质的关键农艺性状,受多个数量性状位点(QTL)的调控,其遗传机制复杂且育种改良难度较大,深入挖掘和利用粒型相关的优良基因资源,对于培育高产、优质、多抗的水稻新品种具有重要意义。本研究鉴定到的染色体片段代换系CSSL-Z255是一个携带18个代换片段的大粒水稻遗传材料,含11个粒型相关QTL,包括4个粒长QTL(qGL-3、qGL-4、qGL-8、qGL-12),2个粒宽QTL(qGW-2、qGW-8),3个长宽比QTL(qRLW-3、qRLW-2、qRLW-8)和2个千粒质量QTL(qGWT-3、qGWT-4)。粒长qGL-3、长宽比qRLW-3和千粒质量qGWT-3均与SSR分子标记RM6266连锁,对该连锁区域内已克隆粒型相关QTL进行分析,发现包含两个OsPPKL1的等位变异(GL3.1和qGL3-1),通过调控细胞周期蛋白T1;3影响籽粒大小[8]。与GL3.1变异材料相比,CSSL-Z255表现出多个育种的有利性状,在分子设计育种中具有巨大的应用潜力,有望通过聚合育种、基因编辑等手段,将优良等位基因快速导入到优良品种中,从而加速水稻粒型的遗传改良进程。此外,这3个QTL(qGL-3、qRLW-3、qGWT-3)还与王大川等[41]鉴定的相同,表明这3个QTL遗传稳定。qGL-4和qGWT-4共同连锁于分子标记RM317,可能属于一因多效QTL。在该代换区间内存在影响两个籽粒形态的基因FLO2和DHT1,FLO2除了调控籽粒大小以外,还对籽粒淀粉品质具有重要影响[42];DHT1编码一种定位于亚细胞核结构(nuclear speckle,核斑)的单子叶特异性hnRNP-like蛋白,属于可参与mRNA前体(pre-mRNA)剪接、mRNA转运和降解等多功能的RNA结合蛋白。dht1突变体的蛋白稳定性和RNA结合活性均受损,导致D14 pre-mRNA剪接发生缺陷,D14表达水平相应降低,减少了D14蛋白,阻碍了独脚金内酯的信号传递,最终导致dht1突变体具有SL信号转导缺陷突变体相似的表型,并且表现为籽粒的粒长与粒宽明显减少[43]。与以上两个突变体相比,Z255籽粒品质并未发生显著变化,说明qGL-4和qGWT-4与FLO2和DHT1可能并非等位基因。qGL-12与RM7120连锁,其区间存在OsYUC11,过表达OsYUC11的水稻植株籽粒变大,垩白度减少,OsYUC11通过影响水稻灌浆来影响籽粒的大小[44]。与过表达OsYUC11的水稻植株相比,Z255籽粒品质并未发生显著变化,说明qGL12和OsYUC11可能并非等位基因。qRLW-2和qGW-2连锁于同一标记RM1385,可能是一因多效QTL,其区间存在OsVPE3,OsVPE3-RNAi株系的粒宽和千粒质量均显著降低,对盐胁迫的耐受性增强,盐胁迫下叶绿素含量和存活率更高。与OsVPE3-RNAi相比,Z255同样参与了籽粒形态发育,但其是否与盐胁迫相关,还需进一步深入研究[45]。因此,为了证明上述已知粒型基因是否为Z255的候选基因,还需精细定位后,对候选基因进行功能互补验证和分子机制解析。此外,本研究中鉴定到的粒型相关QTL(如qGL-8、qGW-8、qRLW-8)还未见有报道,可能为本研究新鉴定到的QTL。表型分析发现这3个QTL可能通过调控细胞增殖与细胞大小来影响籽粒大小,而这3个QTL如何调控细胞增殖和大小,是否与已知通路(基因)有关联,有待进一步深入解析。
-
本研究鉴定到1个包含18个代换片段的大粒染色体片段代换系CSSL-Z255,代换片段平均长度为3.33 Mb。与受体亲本日本晴相比,Z255的粒长和粒宽均极显著增大,呈现出大粒表型。扫描电镜观察和细胞学分析结果表明,Z255的籽粒增大是由于颖壳细胞长度和宽度增大以及细胞的数量增加所致。RT-qPCR结果发现,与日本晴相比,粒型相关基因的表达在Z255上发生了显著的变化。在以日本晴/Z255构建的次级F2代群体中,共鉴定出11个控制粒型的QTL,这些QTL分布在2、3、4、8、12号染色体上。包括4个粒长QTL、2个粒宽QTL、3个长宽比QTL、2个千粒质量QTL。进一步利用MAS法在F3代群体中选育出了21个包含以上粒型相关QTL的次级染色体片段代换系,其中,单片段代换系S1和S2携带qGL-3、qRLW-3、qGWT-3和qRLW-8。







 DownLoad:
DownLoad: