-
在无机化学教学中,为了确定可逆反应平衡移动的方向,引入了勒夏特列原理,但也有难以用勒夏特列原理判断平衡移动方向的情况. 如在合成氨的反应N2+3H2⇌2NH3ΔH<0中,在等温等压条件下,化学反应达到平衡后,再通入N2,体积增大,NH3和H2的浓度都降低,为了减弱NH3的浓度降低,平衡正向移动,符合勒夏特列原理;为了减弱H2的浓度降低,平衡逆向移动,“不符合”勒夏特列原理,这样就产生了矛盾,到底是正向移动还是逆向移动?同理,在等温等压条件下,再通入H2,也会产生同样的矛盾.
上述疑问很难用勒夏特列原理解决,原因在于勒夏特列原理只是一个定性预测化学平衡移动的原理,存在一定的限制条件,有局限性. 已有文献[1-2]利用枚举法说明了在合成氨反应中存在“再加入反应物,平衡逆向移动”的现象. 如何定量解决平衡移动方向的问题,需要利用缜密的数学证明. 已有学者[3-4]证明了在等温等压下N2+3H2⇌2NH3反应达平衡后,当N2的物质的量分数
$\varphi_{\mathrm{N}_2} \geqslant \frac{1}{2}$ 时再加入N2,平衡一定逆向移动;当$\varphi_{\mathrm{N}_2}<\frac{1}{2}$ 时再加入N2,平衡还可能逆向移动吗?另外,该结论可以推广到A+(h+k+1)B⇌hC+kD这一类反应吗?本文将用数学方法证明一类反应A+(h+k+1)B⇌hC+kD,在等温等压条件下达到平衡后,再加入A,平衡可逆向移动,发生“反”勒夏特列现象. 首先利用平衡态时压力平衡常数和新状态时压力熵构建判断平衡移动方向的模型,然后推导出平衡逆向移动所需的反应物A的投料范围,最后将N2+3H2⇌2NH3看作是A+(h+k+1)B⇌hC+kD的特殊例子(h=2,k=0),验证在合成氨中也存在“反”勒夏特列现象. 学生对化学平衡移动原理的深刻认识和理解,有利于提高学生的化学核心素养,也有利于后续学习其他化学学科和进行有关化学平衡的科研工作[5-6].
HTML
-
为了让推导过程易于理解,参考大学教材可使用压力平衡常数(Kp)和压力熵(Qp)判断平衡移动方向[7]. Kp可以用平衡时各物质的分压计算得到,表示方法如下:对于一般的可逆反应mA+nB⇌hC+kD,在一定温度下,
$K_{\mathrm{p}}=\frac{p^h(\mathrm{C}) \cdot p^k(\mathrm{D})}{p^m(\mathrm{~A}) \cdot p^n(\mathrm{~B})}$ ,其中p(A),p(B),p(C),p(D)分别表示平衡时各气体的分压. 该常数只随温度的变化而变化,而不随浓度和压力的变化而变化. 用压力平衡常数(Kp)和压力熵(Qp)的相对大小也可判断平衡移动的方向,压力熵表示为$Q_{\mathrm{p}}=\frac{p^h(\mathrm{C}) \cdot p^k(\mathrm{D})}{p^m(\mathrm{~A}) \cdot p^n(\mathrm{~B})}$ .当Qp < Kp时,化学反应正向进行;当Qp=Kp时,化学反应达到平衡;当Qp>Kp时,化学反应逆向进行[5].
-
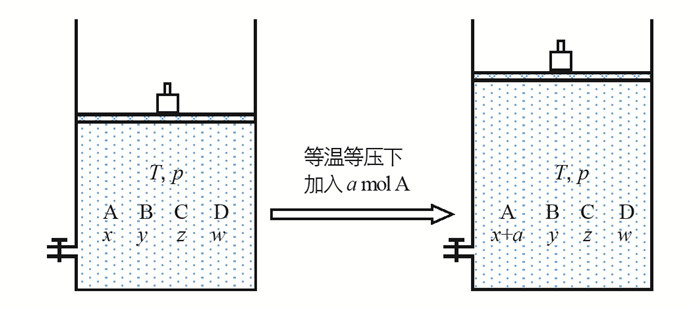
利用Kp和Qp的相对大小可解决用勒夏特列原理解释不了的问题. 对于一般的可逆反应A+(h+k+1)B⇌hC+kD,在等温(T)等压(p)条件下达到平衡后,再加入a mol A(图 1),平衡可能正向移动、不移动或者逆向移动. 具体情况如何,需计算比较Qp与Kp的相对大小来加以判断.
用两段式表示为:A+(h+k+1)B⇌hC+kD
其中x,y,z,w和a均为正数.
在平衡态时,
在新状态时,
当Qp>Kp时,
Ⅰ. 当y+z+w≤x时,即平衡时
$\varphi_{\mathrm{A}} \geqslant \frac{1}{2}$ ,(1)式恒成立,即Qp>Kp,在y+z+w≤x的情况下$\left(\varphi_{\mathrm{A}} \geqslant \frac{1}{2}\right)$ 恒成立,平衡一定逆向移动.Ⅱ. 当y+z+w>x时,即
$\varphi_{\mathrm{A}}<\frac{1}{2}$ ,且$a>\frac{(x+y+z+w)(y+z+w-x)}{x}$ ,此时Qp>Kp,平衡逆向移动.同理可推出以下另外两种情况.
Ⅲ. 当y+z+w >x时,即
$\varphi_A<\frac{1}{2}$ ,且$a=\frac{(x+y+z+w)(y+z+w-x)}{x}$ ,此时Qp=Kp,平衡不移动.Ⅳ. 当y+z+w >x时,即
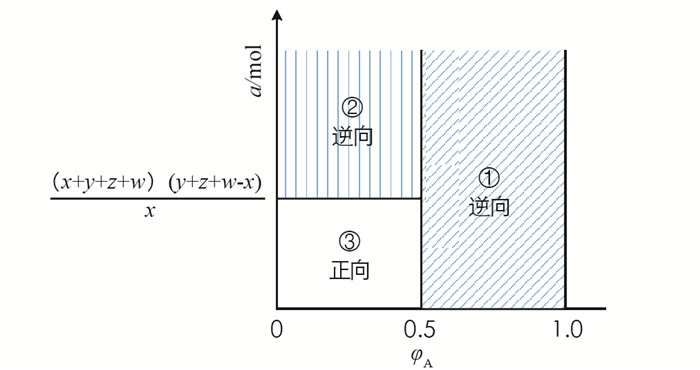
$\varphi_A<\frac{1}{2}$ ,且$ a<\frac{(x+y+z+w)(y+z+w-x)}{x}$ ,此时Qp < Kp,平衡正向移动.综上,对于一般的可逆反应A+(h+k+1)B⇌hC+kD,在等温(T)等压(p)条件下达到平衡时有x mol A,y mol B,z mol C和w mol D,再通入a mol A,当φA和a处于如图 2所示的①区域,平衡逆向移动. 另外,发现当φA和a的值处于②区域,此时
$\varphi_A<\frac{1}{2}$ 且$a>\frac{(x+y+z+w)(y+z+w-x)}{x}$ ,平移依然逆向移动,扩大了再加反应物平衡逆向移动的投料范围. 研究发现表 1中的反应都符合上述结论,从而拓宽了该结论的应用范围.表 1中各反应在等温(T)等压(p)条件下达到平衡后,再加入A,当处于图 2中①和②区域,化学平衡逆向移动,出现“反”勒夏特列原理的现象. 这与文献[8]中提到“存在反常的勒夏特列原理”一致,只不过文献中并没有归纳出更多例具体反应,也没有推导出“违背”勒夏特列原理所需反应物的投料范围. 实际上再加入A,A的物质的量分数较大时,一方面由于体积变大使得B的分压减小,而B的化学计量数较大,使得B分压下降的影响较大,从而使平衡逆向移动;另一方面,A投料时浓度较大,大到一定程度时,受限于B浓度下降,A不能再转化成产物. 虽表面上与勒夏特列原理“相悖”,但实际上与勒夏特列原理相符.
-
N2+3H2⇌2NH3可看作是一类反应A+(h+k+1)B⇌hC+kD中的特殊例子(h=2,k=0). 根据文献[9]得出的工业合成氨条件为投料比n(N2)∶n(H2)=1∶3、温度460 ℃、压强10~30 MPa. 根据文献数据[7]计算得到合成氨反应在460 ℃时的KpΘ=1.56×10-4. 设压强为20 MPa,加入1 mol N2和3 mol H2,列出以下的两段式:
根据
$K_{\mathrm{p}}^{\ominus}=K_x\left(\frac{20 \mathrm{MPa}}{1 \times 10^5 \mathrm{~Pa}}\right)^{-2}=\frac{\left(\frac{2 x}{4-2 x}\right)^2}{\left(\frac{1-x}{4-2 x}\right)\left(\frac{3-3 x}{4-2 x}\right)^3}\left(\frac{20 \times 10^6}{1 \times 10^5}\right)^{-2}=$ =1.56×10-4,计算得到x=0.515,再加入a mol N2,平衡态和新状态表示为:平衡态时N2的物质的量分数
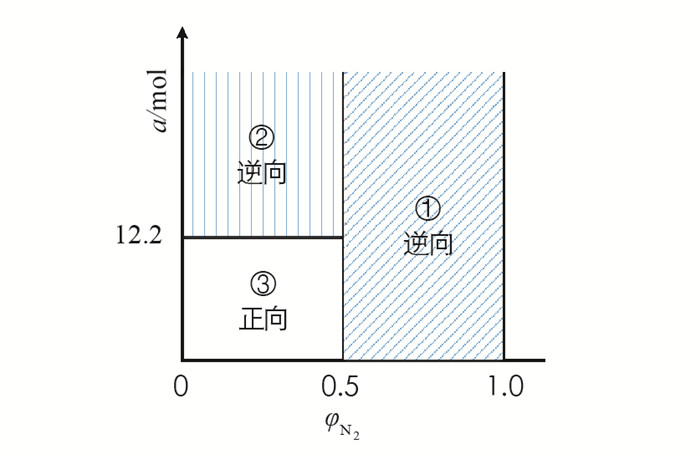
$\varphi_{\mathrm{N}_2}=\frac{0.485}{2.97}=0.163<\frac{1}{2}$ ,故工业合成氨中不存在$\varphi_{\mathrm{N}_2} \geqslant \frac{1}{2}$ ,即不存在图 3中①区域. 根据一类反应A+(h+k+1)B⇌hC+kD的结论可推出工业合成氨中存在的3种可能性.Ⅰ.
$\varphi_{\mathrm{N}_2}<\frac{1}{2}, a>\frac{(x+y+z)(y+z-x)}{x}=$ $\frac{(0.485+1.455+1.030)(1.455+1.030-0.485)}{0.485}$ ,此时Qp>Kp,平衡逆向移动.Ⅱ.
$\varphi_{\mathrm{N}_2}<\frac{1}{2}$ ,且$a=\frac{(x+y+z)(y+z-x)}{x}=12.2$ ,此时Qp=Kp,平衡不移动.Ⅲ.
$\varphi_{\mathrm{N}_2}<\frac{1}{2}$ ,且$a<\frac{(x+y+z)(y+z-x)}{x}=12.2$ ,此时Qp < Kp,平衡正向移动.因此,在460 ℃,20 MPa下,加入1 mol N2和3 mol H2达到平衡后,当再加入N2的量大于12.2 mol,平衡逆向移动. 即工业中合成氨反应时不能只增加N2的投料使平衡正向移动,因为还存在当再加入N2的物质的量a>12.2 mol时,平衡会逆向移动,存在“反”勒夏特列现象. 故一类反应A+(h+k+1)B⇌hC+kD的结论也适用于特殊例子N2+3H2⇌2NH3(h=2,k=0).
-
本文讨论了在A+(h+k+1)B⇌hC+kD一类反应中,在等温(T)等压(p)条件下以任意比例投料达到平衡后,当φA≥1/2时,无论再加入A的物质的量a为多少,平衡一定逆向移动;还发现当φA < 1/2且
$a>\frac{(x+y+z+w)(y+z+w-x)}{x}$ 时,平衡也是逆向移动,拓宽了再加反应物使平衡逆向移动的投料范围. 该“反”勒夏特列原理的结论适用于很多常见反应,包括N2+3H2⇌2NH3. 实际上由于体积增大导致B的浓度下降,限制了A再转化成产物,并且B的化学计量数较大,在压力熵的表达式中影响更大,为了减弱B的分压影响,平衡逆向移动,故本质上与勒夏特列原理相符. 通过对一类具有“反”勒夏特列原理的可逆反应A+(h+k+1)B⇌hC+kD的深入探析,可增强学生的探究意识,打破思维定式,有利于“变化观念和平衡思想”素养的培养,也利于后续其他化学学科的学习.






 DownLoad:
DownLoad: