-
开放科学(资源服务)标识码(OSID):

我国是全球最大的蔬菜生产国,种植面积和总产量均位居世界首位,并持续增长(2023年达2 287万hm2)[1],是仅次于粮食作物的关键农业产业。然而,多种蔬菜害虫的频繁发生严重制约我国蔬菜产业的发展,其中蚜虫、粉虱、小菜蛾、蓟马等害虫,已成为主要的威胁。在极端条件下,一些害虫造成的经济损失甚至超过50%[2]。此外,部分害虫通过传播植物病原物加剧对作物的损害。例如,烟粉虱(Bemisia tabaci)在取食过程中可传播番茄黄化曲叶病毒,显著降低番茄的产量与品质[3]。外来入侵害虫亦对蔬菜生产构成巨大威胁,例如,番茄潜叶蛾(Tuta absoluta)幼虫可潜入寄主叶片,蛀食花蕾与果实,从而显著降低番茄的产量和品质[4]。随着蔬菜害虫发生频次增加和危害程度的不断上升,部分农户为降低虫害,增加了化学农药的施用量。然而,不合理甚至盲目的用药不仅引发了产品安全和环境问题,还加速了害虫抗药性的进化[2],导致防效锐减和成本激增。这一问题不仅威胁我国农业的可持续发展,也对生态环境带来了严峻挑战。因此,保障蔬菜生产安全与推动害虫绿色防控已经成为学界与产业界广泛关注的焦点。我国将生态文明建设纳入中国特色社会主义事业“五位一体”总体布局后,明确提出绿色发展的战略目标。在这一背景下,农业害虫的绿色防控技术取得了显著进展,生物防治作为绿色防控的重要途径,因其环境友好性和可持续性而受到广泛重视。
目前常用的生物防治方法包括利用天敌昆虫、病原微生物以及生物源提取物等,已成为蔬菜害虫综合治理体系中的重要组成部分,为减少化学农药使用、保护农业生态环境做出了显著贡献[5]。然而,这些经典的生物防治策略在田间应用中,仍面临效果稳定性、作用时效性、规模化应用的成本效益以及与现代农业生产体系兼容性等方面的挑战[6-7]。此外,这些方法的作用范围较广,难以精准匹配具体的防治需求,同时也存在潜在的抗性风险[8],这些因素共同限制了传统生物防治策略的充分发挥。这些长期存在的挑战进一步凸显了研发新一代生物防治工具的迫切需求,即需要具备更高精准度、效果更可控、更具创新性的作用机制,并且更易于标准化应用的技术。在此背景下,RNA干扰(RNA interference,RNAi)技术凭借其高度的序列特异性和可设计的靶向性[9],为实现高效、绿色的害虫防控提供了革命性的机会,能够突破传统生物防治的部分局限,并引领精准植保的新方向。
本文总结了近年来各种生物防治方法(包括天敌昆虫、病原微生物、生物源杀虫剂、昆虫病原线虫以及RNAi技术等)的研究进展,重点探讨了RNAi技术的最新突破及其应用潜力。同时,分析了各项技术的优势、局限性及其协同增效的可能性,旨在为构建高效、环保、可持续的蔬菜害虫综合治理策略提供科学依据。
HTML
-
目前国内传统的生物防治方法主要包括天敌昆虫、昆虫病原微生物、生物源杀虫剂、昆虫病原线虫及其他生态调控手段。这些方法在蔬菜害虫防治中发挥了重要作用,并在近年来的应用和研究中取得了一定进展,但也面临一些挑战。
-
害虫天敌主要包括捕食性天敌和寄生性天敌,其中捕食性天敌能够直接捕食蚜虫、蓟马、粉虱等多种蔬菜害虫,涵盖蛛形纲和昆虫纲两大类。目前,研究和应用最为广泛的捕食性天敌包括瓢虫、捕食螨、蝽类、食蚜蝇等。以瓢虫为例,自20世纪50年代起,我国科研人员便开始尝试人工繁育孟氏隐唇瓢虫(Cryptolaemus montrouzieri)和澳洲瓢虫(Rodolia cardinalis)防治吹绵蚧(Icerya purchasi)[10]。目前,多种瓢虫已成功作为商品化生物防治剂用于蔬菜害虫的田间防治,包括异色瓢虫(Harmonia axyridis)、七星瓢虫(Coccinella septempunctata)、龟纹瓢虫(Propylaea japonica)等[11-12]。研究表明,商业化异色瓢虫在设施栽培条件下对菜蚜(Lipaphis erysimi)的防治效果已超过90%[13],并对设施蔬菜中的其他常见害虫(如粉虱、蓟马、害螨等),展现出优异的防治效果。与瓢虫类似,其他捕食性天敌在蔬菜害虫生物防治中同样表现出较好的效果。近年来,随着研究的不断深入,多种昆虫的人工饲料配方得到了显著优化[14-15]。此外,饲料微胶囊化技术的应用也提高了捕食性天敌人工繁育时的成活率和发育状态,而天敌滞育技术的进展则大大便利了商品化天敌的销售和应用[16-17]。然而,仍有不少天敌面临饲养成本高、繁育难度大的问题。
寄生性天敌主要为膜翅目寄生蜂,寄生蜂通过将卵产于害虫体内或体表,其幼虫以害虫为食,最终导致害虫死亡。在蔬菜害虫的生物防治中,应用最为广泛的寄生蜂包括烟蚜茧蜂(Aphidius gifuensis)、螟黄赤眼蜂(Trichogramma chilonis)、丽蚜小蜂(Encarsia formosa)等[18]。对于外来入侵害虫番茄潜叶蛾,螟黄赤眼蜂的最高防治效果可达76%[19]。自2014年起,烟蚜茧蜂已在全国范围内推广应用,特别是在烟区实现了全覆盖[20]。目前,寄生蜂的人工饲养主要依赖于扩大中间寄主的研究,以提高人工饲养规模。例如,麦蛾柔茧蜂(Habrobracon hebetor)是多种鳞翅目害虫的天敌,研究表明,以印度谷螟(Plodia interpunctella)作为中间寄主可以获得较高的孵化率和寄生率[21]。此外,关于寄生蜂的释放方式的研究发现,少量多次释放且放蜂点间距离较近时,防治效果较好[22]。
害虫天敌的使用具有广谱性、安全性以及不易产生抗性等优点,但其控害效果受环境条件(如温度、湿度、化学农药使用等)的影响[23]。此外,部分天敌存在专一性不足的问题,可能对非靶标生物产生负面影响。例如,烟盲蝽在作为害虫天敌的同时,也可能对某些农作物造成危害[24]。尽管目前关于天敌昆虫规模化饲养的研究较为丰富,但天敌昆虫的使用成本仍无法与化学农药竞争,这是影响其普及应用的主要原因之一。此外,不当使用化学农药会严重杀伤天敌[25],进一步降低了其效费比。
-
昆虫病原微生物包括虫生真菌、细菌和昆虫特异性病毒等。昆虫病原真菌作为一种环境友好的生物防治工具,因其具有高效性、特异性和环境安全性的优点,已成为绿色农业的重要选择。其中,球孢白僵菌(Beauveria bassiana)作为生物防治中效果最为显著的真菌之一,目前国内已注册的相关产品超过30种[26]。球孢白僵菌对小菜蛾(Plutella xylostella)、白粉虱(Trialeurodes vaporariorum)、蛴螬等多种蔬菜害虫具有极佳的防治效果,在蔬菜害虫的生物防治中发挥了重要作用[27]。研究表明,白僵菌可通过根部灌注方式定殖于植物组织中;此外,利用喷雾干燥技术将白僵菌气生孢子微胶囊化,能够显著提升孢子的热稳定性和致病性[28],这两项技术均可有效增强白僵菌的致病性。除白僵菌外,绿僵菌(Metarhizium spp.)、玫烟色棒束孢(Isaria spp.)等同样是研究和应用较为广泛的虫生真菌,这些真菌在控制蓟马、二斑叶螨(Tetranychus urticae)、番茄潜叶蛾和小菜蛾等蔬菜害虫方面均表现出了优异的防治效果[29-31]。尽管多数真菌在田间防治效果较好,但在实际应用中,应充分考虑环境条件对昆虫病原真菌效果的影响,以及害虫可能产生的抗性[32]。
昆虫病原细菌的研究主要集中在苏云金芽胞杆菌(Bacillus thuringiensis)上。苏云金芽胞杆菌因其对多种鳞翅目蔬菜害虫,例如,小菜蛾、菜青虫(Pieris rapae)及甜菜夜蛾(Spodoptera exigua)具有高效的防治能力,一直是研究的热点,每年都有大量相关研究报道,涵盖其作用机制、抗性机制以及生产应用等多个方面。目前,苏云金芽胞杆菌主要通过农药制剂直接用于害虫防治,并可与增效剂或化学农药复配后使用[33]。尽管苏云金芽胞杆菌转基因棉花已在新疆大规模种植,但由于政策和公众接受度等因素,其在蔬菜害虫防治中的应用仍面临挑战。许多研究还聚焦于从不同来源分离和鉴定具有高致病性的菌株,探索其在生物防治中的应用潜力,包括粘质沙雷氏菌(Serratia ficaria)、不解糖假苍白杆菌(Pseudochrobactrum asaccharolyticum)、霍氏致病杆菌(Xenorhabdus hominickii)、霍氏肠杆菌(Enterobacter hormaechei)等[34-35],其中一些菌株对害虫的致死率极高,例如,不解糖假苍白杆菌Nan-Y菌株在高浓度处理下对鳞翅目害虫的致死率可在6 d内达到100%[36]。
昆虫特异性病毒(Insect Specific Virus,ISV)是指仅以昆虫为宿主的病毒。核多角体病毒(Nucleopolyhedrovirus,NPV)作为一种高效的生物防治病原微生物,已广泛应用于蔬菜害虫的防治。目前,用于蔬菜害虫防治的核多角体病毒包括菜青虫颗粒体病毒、甘蓝夜蛾核型多角体病毒、甜菜夜蛾核型多角体病毒、斜纹夜蛾多角体病毒、小菜蛾颗粒体病毒以及苜蓿银纹夜蛾核型多角体病毒等[2, 37]。昆虫病毒因其生物学特性,能够与多种化学杀虫剂或植物源药剂联合使用,显著提高其应用效果。例如,玉米螟核多角体病毒与乙基多杀菌素联合施用时,杀虫效率提高至86.66%[38]。除核多角体病毒外,浓核病毒对桃蚜(Myzus persicae)也具有较好的防治效果,能够显著降低桃蚜的繁殖能力、缩短产蚜时间并减缓种群增长速率[39]。
昆虫病原微生物具有环境友好、对非靶标生物安全等优点,但其效果容易受到环境条件(如紫外线、湿度等)的影响,且部分害虫可能对其产生抗性。这些固有的局限性推动了研究人员不断探索改良策略,例如,通过基因工程技术筛选或改造具有更强环境耐受性和更高毒力的菌株,以及发展新型制剂技术,以提高其在田间的稳定性和持效性。
-
生物源杀虫剂是来源于生物体(如植物、微生物和节肢动物)的具有杀虫活性的物质。其中,植物源杀虫剂是研究和应用最广泛的一类,例如,除虫菊素、印楝素、苦参碱等能通过触杀、胃毒等方式有效杀死鳞翅目昆虫、蚜虫、螨类等多种害虫[40-41]。这些植物源杀虫剂不仅具有优异的杀虫效果,还展现出较高的环境友好性。例如,1%苦皮藤素水乳剂和0.5%苦参碱水剂对双斑萤叶甲(Monolepta hieroglyphica)的防效分别达到99.65%和96.08%[42]。苦参碱的环境行为研究中发现,施药后有效成分主要集中在土壤表层,并易被微生物降解、不易残留;此外,苦参碱在水体环境中易发生光解,其光解半衰期在1 h内,因此对土壤和水体环境较为安全[43]。与苦参碱类似,相较于许多化学合成农药,大多数植物源药剂因其天然结构,通常更易在环境中通过光解、微生物降解等途径分解,残留期相对较短[44]。此外,部分节肢动物(如蜘蛛和黄蜂)的毒液以及微生物的代谢产物也是重要的生物源杀虫剂[45-46]。例如,从多刺甘蔗多孢菌(Saccharopolyspora spinosa)中提取的多杀菌素和乙基多杀菌素已成为重要的商业化产品[47]。虽然生物源杀虫剂相较于天敌或病原微生物对环境条件的要求较低,但其持效期较短、易分解等问题仍不容忽视。此外,生物源杀虫剂的生产需提取植物或微生物的相关杀虫活性成分,导致其成本较高,影响市场推广,长期单一使用也可能导致害虫产生抗性。
-
昆虫病原线虫是一类能够寄生昆虫并导致其死亡的线虫,主要包括斯氏线虫科和小杆线虫科的成员。昆虫病原线虫对多种蔬菜害虫具有较高的致死率,例如,异小杆线虫(Heterorhabditis bacteriophora)对番茄潜叶蛾幼虫的致死率高达98%[48]。此外,昆虫病原线虫共生菌嗜线虫致病杆菌(Xenorhabdus nematophila)和发光光杆状菌(Photorhabdus luminescens)也展现出显著的致死效果[49]。昆虫病原线虫具有环境友好性,对人畜无害,但其应用受环境条件(如湿度和温度)和施用技术的限制。尽管目前已开发出多种线虫存活介质以提高其在大田环境下的存活时间,但其商业化生产尚未实现。
另外,利用昆虫信息素干扰害虫交配或诱捕昆虫、利用植物挥发物驱避或诱集害虫、通过间作或轮作改善田间生态环境等方法也属于生物防治范畴。相关研究发现,功能植物可通过涵养天敌产生天然生物防治剂的效果[50]。其中,蛇床(Cnidium monnieri)作为一种优秀的功能植物,因其极强的天敌涵养能力,在蔬菜害虫防治中起到了重要的启发作用[51]。这些方法通常与其他生物防治技术或农业措施结合使用,以提高整体防治效果。然而,这些生态调控和行为干扰策略并非完美。信息素的作用高度专一,难以应对复合型害虫;而间作、功能植物等生态工程方法的设计与效果评估较为复杂,通常见效较慢,且需要较大范围的协调实施。因此,这些方法更适合作为综合治理体系的组成部分。
1.1. 天敌
1.2. 昆虫病原微生物
1.3. 生物源杀虫剂
1.4. 其他生物防治措施
-
近年来,随着基础研究的深入和关键技术的突破,RNAi在蔬菜害虫防治领域的应用取得了显著进展,甚至开始迈向商业化。2023年,首个喷施型RNAi农药(Calantha)成功上市,并已用于马铃薯甲虫(Leptinotarsa decemlineata)的防治[52]。这一科技成果被Science杂志评选为“2024年度十大科学突破”之一,标志着RNAi技术正加速从基础研究向田间应用转化。
-
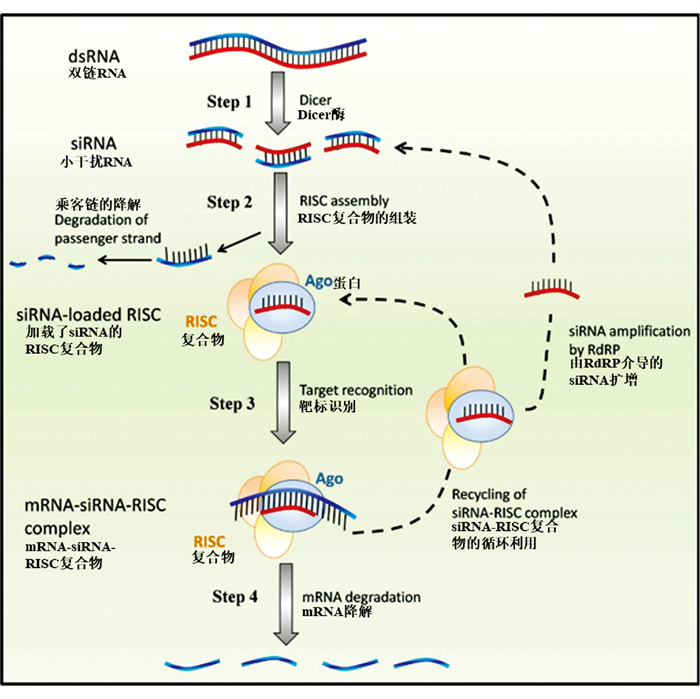
RNAi是一种保守的转录后基因沉默机制(图 1)[53]。简而言之,外源dsRNA进入昆虫细胞后,会被Dicer-2酶切割成小干扰RNA(Small Interfering RNA,siRNA)。siRNA的反义链随后被整合进RNA诱导沉默复合体(RNA-induced Silencing Complex,RISC),引导RISC识别并切割与其互补的靶标信使RNA(Messenger RNA,mRNA),最终导致目标基因的沉默[54-55]。
-
选择合适的靶标基因对RNAi技术的成功至关重要。理想的靶标应具备功能关键性(影响生存或繁殖)、序列特异性(降低脱靶风险)等特点。针对小菜蛾、烟粉虱、蚜虫等主要蔬菜害虫,研究已验证多类有效的靶标基因,例如,涉及几丁质合成、能量代谢、激素调控、神经传递等通路的关键基因[56-58]。与此同时,利用生物信息学工具优化dsRNA序列设计,以提高沉默效率并预测潜在的脱靶效应,也是当前的重要研究方向。针对这一目标,已开发出dsRNAEngineer在线工具,帮助实现全面的dsRNA设计[59]。
-
将dsRNA分子稳定、高效地递送至害虫体内是RNAi技术在田间应用成功与否的关键。目前,主要有两种方式:①植物介导的RNAi(Plant-Mediated RNA Interference,PMiRNA)。该方式通过遗传转化使作物稳定表达dsRNA/hpRNA,害虫取食后触发RNAi[60]。该策略已在防治根萤叶甲等鞘翅目害虫方面实现商业化应用。②非转化体策略。通过外部施用dsRNA制剂,避免了转基因相关问题。其中,叶面喷雾是目前发展最快且应用最灵活的方式。
为提高非转化体策略的效果,开发高效的递送系统至关重要。纳米载体技术作为当前的主流方向,通过利用纳米载体生物包裹dsRNA,以保护其稳定性、延长持效期,并促进害虫吸收,是纳米材料开发的主要目标。目前常见的纳米载体包括聚合物(如壳聚糖)、脂质体、无机纳米颗粒(如LDHs、MSNs等)以及合成聚合物等材料,这些材料均展现出良好的效果,但大多数仍停留在实验阶段[61-62]。例如,星形聚合物(Star-Polymer,SPc)可显著上调细胞关键基因,激活网格蛋白介导的内吞作用,促进细胞对dsRNA/SPc复合物的摄取。此外,星形聚合物还可能促进dsRNA的胞外分泌和细胞间扩散,从而增强昆虫全身RNAi效应[63]。星形聚合物不仅能有效包裹dsRNA,还可将化学农药纳米化,两者结合使用可显著提高对害虫的防治效果[64]。
-
开发低成本、高效率的dsRNA规模化生产工艺是当前研究的重点之一。其中,基于微生物发酵的方法是最常用的,特别是利用基因工程改造的大肠杆菌(如RNase Ⅲ缺陷株)表达目标dsRNA或其前体(如hpRNA)[65-68]。该方法技术相对成熟,易于放大,但仍面临内毒素去除、纯化工艺复杂等挑战。为了进一步降低成本并提高灵活性,诸如无细胞合成系统、利用噬菌体RNA聚合酶体外转录、以及基于酵母、植物细胞或工程化微生物的新型生物反应器等策略,正积极探索中[69-70]。持续优化生产工艺和降低成本是推动RNAi技术广泛应用的重要保障。
-
目前,RNAi生物农药的商业化进程正在加快。以代表性产品“Calantha”为例,这是一种基于dsRNA的生物杀虫剂,在美国已获得登记批准,通过靶向Snf7基因选择性防治马铃薯甲虫[69]。据报道,该药剂对马铃薯甲虫的所有生命阶段均有效,且对非靶标生物的影响较小[70]。研究发现,在马铃薯甲虫高发的情况下,Calantha处理组的马铃薯块茎产量约为3.30 t/hm2,显著高于未处理对照组,并与标准杀虫剂处理组相当;在正常使用条件下,对非靶标生物几乎无显著性影响,对人类健康和环境同样无不利影响[71-72]。该产品的商业化成功证明了喷施型RNAi技术在田间大规模防治害虫的可行性,对整个领域的发展具有重要的示范和推动作用。除“Calantha”外,基于RNAi技术的其他生物防治产品目前也已问世(表 1)[73]。
-
RNAi技术作为一种新型生物防治工具,具有独特的优势,但也存在一定的局限性。其主要优势包括:①高度的靶标特异性为精准打击害虫、保护非靶标生物提供了可能;②新颖的作用机制为治理抗性害虫和延缓抗性发展提供了新武器;③设计的灵活性使其能够快速响应靶标变化或通过组合实现特定的谱宽,以及良好的环境兼容性和与其他绿色防控措施的整合潜力。然而,RNAi技术的广泛应用仍面临一定挑战,例如,dsRNA在田间的稳定性与持效性有待提高,其发挥作用的时间较长,导致速效性相对较慢,以及当前的生产和应用成本可能仍高于部分传统药剂等。尽管与传统生物防治措施相比,RNAi技术存在一些短板,但其独特的优势使其在未来的生物防治中仍占有重要地位(表 2)。
-
RNAi技术并非孤立存在,其与现有生物防治方法的融合被认为是未来发展的重要方向,有望实现“1+1>2”的效果。例如,RNAi的高选择性使其能够与天敌昆虫保护策略兼容,甚至可能通过削弱害虫的防御机制来辅助天敌的作用。与昆虫病原微生物结合时,RNAi可抑制害虫的免疫反应,增强病原的致病力,或探索利用微生物作为dsRNA的递送载体。对于生物源杀虫剂(或化学农药),基于纳米技术的共递送系统则为实现协同增效、降低用量和管理抗性提供了可能。研究发现,通过dsRNA干扰蚜虫唾液腺,当蚜虫取食植物时,植物会产生更多挥发性物质,从而吸引天敌[74];另一项研究表明,喷施dsRNA靶向蚜虫免疫相关基因可显著增加白僵菌的毒力[75]。这些技术融合策略为构建蔬菜害虫综合治理提供了巨大的推动作用。
2.1. RNAi的作用机制
2.2. 技术创新趋势
2.2.1. 靶标筛选与dsRNA设计
2.2.2. dsRNA递送策略
2.2.3. dsRNA的规模化生产
2.3. 商业化进程
2.4. 技术特征比较
2.5. 技术融合潜力
-
在可持续发展的背景下,生物防治无疑将成为未来蔬菜害虫综合防控的关键环节。本文系统回顾了近年来蔬菜害虫生物防治的研究进展,分析了包括天敌昆虫、昆虫病原微生物、生物源杀虫剂以及生态调控等传统生物防治方法的应用现状与局限性。这些传统策略构成了绿色防控的基础,取得了显著成效,但在稳定性、作用速度、应用成本及与现代农业的兼容性等方面仍面临瓶颈,难以完全替代化学农药。在此背景下,以RNA干扰(RNAi)技术为代表的新型生物防治工具迅速发展。RNAi技术凭借其前所未有的靶标特异性、新颖的作用机制和高度的设计灵活性,在害虫防治中展现出巨大的潜力。然而,RNAi技术要真正成为田间常规工具,仍需解决稳定性、持效性、递送效率和成本控制等实际挑战。
未来,蔬菜害虫的可持续治理并非仅仅依赖RNAi技术取代传统方法,而在于构建一个以综合害虫管理理念为指导的综合防治体系,将RNAi技术与现有绿色防控手段有机整合、协同增效。核心发展方向包括:①优化RNAi应用技术,持续研发更稳定、高效、低成本的dsRNA递送系统和生产工艺,建立完善的环境风险评估与抗性监测管理规范。②探索RNAi与其他生物防治方法的协同模式。③将RNAi技术融入综合害虫管理策略,依据田间精准监测,将其与天敌、微生物、化学防治等多种措施科学轮换或组合使用。最终目标是推动RNAi技术深度融入现有综合害虫管理体系,使其成为提升防治体系精准性和可持续性的关键技术。通过与天敌利用、微生物防治等其他绿色措施的优势互补与协同作用,共同构建适应不同需求的蔬菜害虫综合治理新模式。





 DownLoad:
DownLoad: