全文HTML
-
超重/肥胖在世界范围内的许多国家都在迅速增加。随着我国经济的高速发展,超重/肥胖个体也在逐渐增多,2014年柳叶刀(The Lancet)发表的关于中国肥胖现状与健康关系的研究报告显示,2013年我国有3.8%的男性和5.0%的女性存在肥胖问题,肥胖人口仅次于美国[1]。2016年柳叶刀数据显示我国肥胖人口(8 960万)在2014年已超过美国,位居世界首位[2]。另外,我国儿童和青少年的超重/肥胖问题也日益严重,儿童和青少年的超重/肥胖发生率从1995年的5.3%迅速增长到2014年的20.5%[3]。肥胖还会增加罹患身心疾病的风险,如Ⅱ型糖尿病、高血压、高血脂、冠心病、癌症、胆囊疾病和中风等[4]。据统计仅2010年,全球就有约340万人死于超重/肥胖问题的并发症[5]。
随着认知神经科学的快速发展,越来越多的研究者重点关注认知功能与超重/肥胖的关系。Lowe等人从神经科学的视角综述以往有关肥胖与执行控制、奖赏和脑功能等方面的研究[6],并提出相互影响循环模型。该模型显示执行控制相关脑区[外侧前额皮层(lateral prefrontal cortex,lateral PFC)]活动的下降,奖赏相关脑区[纹状体(Striatum),腹内侧前额皮层(ventromedial PFC,vmPFC),眶额叶皮层(orbitofrontal cortex, OFC)]活动的增强,表现为执行控制能力下降和奖赏敏感性升高,导致个体饮食自我控制的下降,进而出现过度进食,体重升高或肥胖等现象,肥胖又影响到前额皮层功能异常和执行控制能力受损,所以执行控制能力、脑机制和肥胖之间相互影响(见图 1)。本文主要从执行控制(executive control)角度,探讨超重/肥胖对青少年执行控制的行为学和脑功能的影响,并总结体重控制的干预方法。执行控制包括多种高级认知能力,包括对潜在的神经认知加工过程的监控能力、有意识的注意转移、抑制优势反应、激活非优势反应以达到更高的目标[7]。本文把反应控制、冲突控制和冲动控制界定为执行控制的三种核心成分。首先探讨超重/肥胖对青少年反应控制、冲突控制和冲动控制行为学和脑功能的影响,然后总结体重控制的干预方法,最后从长期纵向研究、多模态脑成像研究和多种干预技术相结合三个方面提出未来可能的研究方向。
-
反应控制指抑制外界线索优势或自动化反应,以至于对目标或环境需要做出正确的反应[8]。超重/肥胖会导致个体的反应控制能力下降,使个体不能较好的抑制优势反应和习惯化反应。反应控制通常采用Go/No-go任务和停止信号任务(Stop Signal Task, SST)进行测量。本文主要基于Go/No-go和SST任务,考察超重/肥胖对青少年反应控制的影响。
-
以往研究采用复杂的Go/No-go任务,实验材料使用字母“X”和“O”,要求被试对刺激进行快速的按键反应(Go),但是当前刺激与前一刺激重复出现时被试需要抑制自己的反应(No-go)。研究发现肥胖儿童No-go的正确率显著小于正常体重儿童[9],肥胖儿童不能及时抑制自己的优势化反应,表明与正常体重儿童相比,肥胖儿童的反应抑制能力较低。除此之外,超重/肥胖不仅影响个体执行任务的正确率,还会影响反应时。如,在一般刺激的Go/No-go任务中,发现超重儿童有较大的反应时(Reaction time, RT)变异性(variability)[10]。较小的反应时变异性被认为是成功Go和No-go的指标[11],而且具体较大的反应时变异性的个体不能有效使用引导反应选择所需的前运动脑区,所以需要高级的前额脑区以产生适当的反应[12],也就是说超重儿童需要调用高级脑区的资源以做出适当的反应[10]。超重/肥胖既影响个体执行一般刺激任务的能力,对执行食物特异任务的能力也有影响。Deux等人使用两个Go/No-go任务,一个使用一般刺激,另一个使用高、低热量食物刺激,研究发现超重青少年的No-go错误率均显著大于非超重青少年,暗示超重青少年的一般和食物特异性反应控制能力均显著降低[13]。在执行一般刺激的SST时,肥胖儿童的SSRT显著大于正常体重儿童[14],SSRT越大说明个体的反应控制能力越弱,暗示肥胖儿童执行SST时一般反应控制能力降低。Nederkoorn等人同时使用食物刺激和玩具刺激的SST,结果显示,与正常体重儿童相比,超重儿童对食物刺激的反应抑制能力更差[15],进一步推论反应控制能力可能是影响青少年暴饮暴食或过度进食的重要因素之一。
-
脑影像学证据显示抑制控制能力主要与前额叶脑区的活动有关,如腹外侧前额皮层(Ventrolateral Prefrontal Cortex, vlPFC)、内侧前额皮层(Medial Prefrontal Cortex, mPFC)、背外侧前额皮层(Dorsolateral Prefrontal Cortex, dlPFC)和额下皮层(Inferior Frontal Cortex, IFC)等[16-18]。当要求被试对食物渴求进行调节或抑制时,左侧dlPFC、双侧中扣带回和颞顶联合区的活动增强,说明dlPFC是下调高热量食物的奖赏属性的关键脑区。有研究表明体重指数(Body Mass Index, BMI)与dlPFC、vlPFC和额下回(Inferior Frontal Gyrus, IFG)的激活呈显著的负相关,暗示肥胖个体调用dlPFC来调节食物选择的能力降低[6, 19]。另外,dlPFC和腹内侧前额皮层之间较弱的功能连接降低了dlPFC下调vmPFC中味道属性的能力,增加个体根据味道选择食物的可能性,说明饮食的自我控制的成功可能取决于dlPFC调节vmPFC中的味道和健康评估的能力[6, 20]。
超重/肥胖会导致青少年与抑制控制能力相关脑区的活动减弱,但是与奖赏相关的脑区活动会增强。与较瘦的青少年相比,超重青少年对美味食物进行抑制时,前额抑制相关脑区的激活降低,包括额上回(Superior Frontal Gyri, SFG)、额中回(Middle Frontal Gyrus, MFG)、腹外侧前额皮层、内侧前额皮层和眶额叶皮层,然而奖赏相关脑区的激活(如脑岛)则与BMI呈显著的正相关[21],而且肥胖儿童在观看不健康食物Logo时,其认知控制相关脑区激活较低,包括双侧额中皮层(Middle Frontal Cortex, MFC)和额下皮层,暗示肥胖儿童更易受食物广告的影响[22]。
一. 超重/肥胖对青少年反应控制行为的影响
二. 超重/肥胖对青少年反应控制脑功能的影响
-
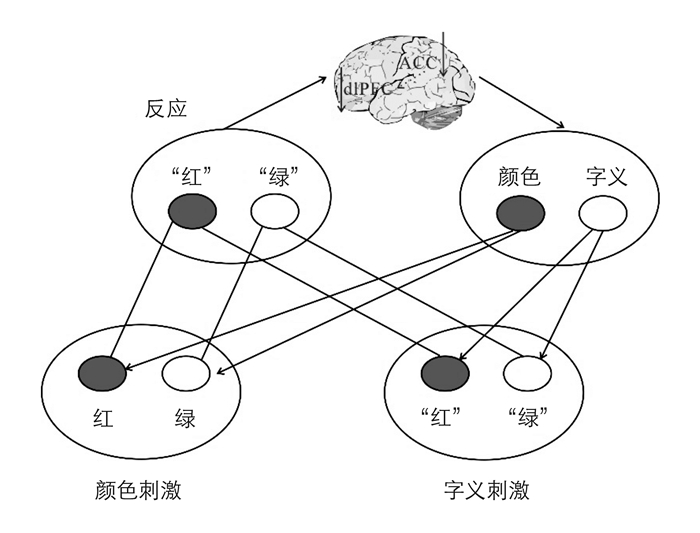
当不同表征同时出现并互相干扰时,则会出现认知冲突,大脑监控到信息处理过程中出现的冲突,并对冲突信息做出不同反应的能力是冲突控制能力[23]。冲突控制常用Stroop任务来测量,表明个体受冲突干扰的程度。经典的Color-word Stroop任务,使用颜色和字义的不同表达冲突,如蓝色颜色写的“红”字即存在冲突。
-
使用经典Color-word Stroop任务的研究发现,超重/肥胖青少年在任务中反应时显著大于正常体重的青少年[10],说明超重/肥胖会影响青少年对冲突信息的处理速度。另外,肥胖青少年在Color-word Stroop任务中的得分也显著小于较瘦青少年[24],暗示超重/肥胖也会影响青少年对冲突信息的处理正确率。有趣的是,有研究显示肥胖青少年在执行Color-word Stroop任务时对字义的反应表现差于正常体重青少年,而没有发现对颜色反应的组间差异[25],可能说明了超重/肥胖首先会影响到个体对语言冲突信息的解决。在4周的干预研究中发现,超重/肥胖青少年在Stroop任务中较好的表现可以预测未来更大的体重减少[26]。另外,在其他实验范式中也发现超重/肥胖会影响个体的冲突控制能力。如肥胖儿童在执行Flanker任务时,肥胖儿童在不一致条件下的反应时显著大于正常体重儿童,说明正常体重儿童可以灵活调用认知资源以维持冲突状态下的任务表现,而肥胖儿童调用资源维持冲突的能力较弱[27]。在执行Simon任务时,肥胖儿童任务错误率显著大于正常体重儿童[28]。综上所述,以往研究采用不同的实验范式均发现肥胖儿童冲突控制能力减弱,说明超重/肥胖影响儿童青少年对冲突信息的处理速度和正确率具有实验范式间的一致性。
-
功能性近红外光谱学(functional near infrared spectroscopy, fNIRS)研究显示BMI越大,Stroop任务中的前额皮层的血氧动力反应(hemodynamic response)就越小[29],而且超重/肥胖青少年在Stroop任务中的左侧腹外侧前额皮层(left vlPFC)和双侧背外侧前额皮层(bilateral dlPFC)较大的血氧动力反应与短期干预后更多的减重有关,说明前额皮层可能调节超重/肥胖青少年的执行控制对其食物摄入和减肥的影响[26]。Yokum等人探讨青少年在执行一般刺激和食物刺激的注意网络任务(Attention Network Task, ANT)中的脑机制时发现,在对食物的早期定向阶段,BMI与前脑岛、外侧OFC、腹外侧前额皮层、顶上小叶(superior parietallobe)等的较大激活有关,而且在对美味食物早期定向阶段的外侧OFC较大激活可以预测未来BMI的增大,说明超重与对食物的注意偏向有关[30]。具有暴饮暴食症的肥胖青少年在执行Stroop任务时,腹内侧前额皮层、额下回和脑岛(insula)的激活较小,而且其限制性饮食得分与右侧IFG和vmPFC的激活呈显著的负相关,说明具有暴饮暴食症的肥胖青少年的冲突控制能力的下降可能与受损的限制性饮食有关[31]。Janssen等人根据被试的BMI计算了每个被试的肥胖得分,研究发现在被试执行食物选择任务时,肥胖得分越大,外侧前额皮层的激活就越小,说明食物选择控制能力的下降可能会导致肥胖[32]。
目前,超重/肥胖对青少年基于Stroop任务的冲突控制的脑机制研究还比较少,而且没有阐明其关键脑区。冲突监控理论认为,大脑的冲突监控系统首先评估当前的冲突水平,然后将冲突信息传递到负责控制的中枢,然后由控制中枢对行为进行调控。前扣带回(Anterior Cingulate Cortex, ACC)是冲突监控的重要中枢,dlPFC是对冲突信息进行调控的重要中枢[23, 33-34]。基于Color-word Stroop任务建立的关于冲突监控和冲突控制的模型[23, 33-34]认为,当字义和字的书写颜色不同时即产生冲突,首先需要激活ACC进行冲突监控,然后将冲突信息传入到dlPFC进行冲突控制。然而,据我们所知,目前仍不清楚超重/肥胖是怎样影响个体执行Stroop任务时的ACC和dlPFC的功能。基于超重/肥胖对个体脑功能的影响,我们认为超重/肥胖个体在执行Stroop任务时,ACC对冲突信息的监控能力减弱,即ACC激活降低,也表现了超重/肥胖个体对冲突信息行为反应上的迟缓;另外,ACC到dlPFC之间的冲突信息传递效率降低,可能表现为两者间功能连接的减弱;最后,dlPFC对冲突信息的控制能力减弱,即dlPFC激活降低,也表现了超重/肥胖个体对冲突信息行为反应正确率的降低(见图 2)。
一. 超重/肥胖对青少年冲突控制行为的影响
二. 超重/肥胖对青少年冲突控制脑功能的影响
-
冲动控制是对冲动行为的控制能力。以往文献显示超重/肥胖会影响个体的冲动控制能力,使个体具有较高的冲动性。作为一种人格特质,具有冲动性特质的个体面对事件通常会做出无意识的、快速的、无计划的和缺乏远见的行为反应,很少或从不考虑或是缺乏评估这些行为后果是否会对自身或他人带来负面的影响[35]。本文主要从冲动性决策的角度探讨超重/肥胖对青少年冲动控制的影响。决策是指在多种选择的情况下选择一种方案的过程[36]。一般个体通过评估与权衡收益及付出的成本,然后做出最有利的选择,而超重/肥胖个体由于冲动控制的缺陷往往做出冲动决策。冲动性决策常使用延迟折扣任务(Delayed Discounting Task, DDT)测量。通常认为选择较小的立即奖励(Immediate rewards, IRs)与冲动性有关,而选择较大的延迟奖励(Delayed rewards, DRs)则与自我控制相关[37]。
-
自我控制的双加工理论认为,健康的生活方式取决于冲动系统(impulsive system)和反思系统(reflective system)之间的平衡,认为过度进食高热量食物是未充分调用执行控制而冲动的结果[38]。所以,冲动性被认为是过量饮食的重要因素之一[39]。在对年轻女性的研究中发现,与冲动水平较低的个体相比,冲动水平较高的个体会食用较多的美味食物[40]。
关于肥胖儿童/青少年的冲动控制问题,早在1983年Bonato等人研究发现在DDT中,与较大的延迟奖励相比,肥胖儿童则较多选择立即奖励[41],即肥胖儿童表现出较高的冲动性。在DDT中,与正常体重的青少年相比,肥胖青少年表现出更大的延迟折扣率[42],延迟折扣率越大说明冲动性越高,即肥胖青少年在DDT中表现出较高的冲动性。预测研究发现,肥胖青少年冲动性的改善可以有效预测体重的减少[14]。另外,在执行Door Open task(一种测量儿童奖赏优势的任务)时,与正常体重儿童相比,肥胖儿童打开了更多的doors[43],说明肥胖儿童的奖赏敏感性较高,而冲动控制能力较差。还有研究探讨食物暴露对超重/肥胖青少年风险决策的影响。研究发现食物暴露后,超重青少年风险决策增加,而且饥饿水平升高,说明食物暴露后可能会导致超重青少年过度进食[44]。最近的研究发现,特质冲动性可以直接影响超重/肥胖青少年增加饮食失调的倾向[45]。综上所述,作为一种人格特质,冲动性可能对肥胖的发展、维持以及干预有重要的作用。
-
肥胖女性执行DDT时,与简单试次相比,较难试次中较大的延迟折扣率(较高的冲动性)与额中回、额下回和顶下小叶(Inferior parietal lobule)激活降低有关[46],而且与简单试次相比,较难试次中额下回,额中回和额上回较低的激活可以预测以后体重更大的增加[47],说明冲动性水平越高,则控制相关脑区激活就越低,而且未来体重增加的风险就越大。然而,冲动控制能力较好的个体会减少更多的体重,而且背外侧前额叶皮层和腹内侧前额皮层的活动与体重减少相关,dlPFC和vmPFC的功能连接越强,则限制饮食和冲动性控制越成功[48];与正常体重儿童相比,肥胖儿童的左侧额中回(left MFG, 执行控制相关脑区)与左腹内侧前额皮层(left VMPFC)/左外眶额叶皮层(left lateral OFC, 奖赏相关脑区)的静息态功能连接增强[49],说明冲动控制相关脑区和奖赏相关脑区的交互作用会影响个体的饮食行为和体重的维持。超重和正常体重的青少年在执行风险收益任务时,两组被试的双侧尾状核、额下回和前脑岛均有激活,而且超重青少年中岛也有激活,相关分析发现超重青少年的外部性进食得分(荷兰饮食行为问卷的一个维度)与后部脑岛的激活有显著的正相关,但是其限制性饮食得分与双侧脑岛的激活有显著的负相关,说明青少年肥胖可能与脑岛系统向内感受输入信息的中断有关[50]。超重/肥胖个体的冲动控制不仅与脑功能有关,而且与脑结构也有关。例如研究显示青少年体脂与内侧OFC体积的相关受冲动性的调节[51]。
目前,研究领域里存在两种基于神经影像学视角提出的冲动性的双系统神经模型。首先,Laibson于1997年提出β系统和δ系统。他们认为β系统的激活与立即奖励有关,主要包括腹侧纹状体,旁边缘皮层(paralimbic cortical structures,与多巴胺能的神经分布有关)。δ系统主要包括外侧前额叶和顶叶区,与高水平的协调加工过程有关,该系统的激活与延迟奖励有关[52],所以β系统更多涉及的是奖赏功能,反应的是个体的冲动性,而δ系统更多反应的是个体的执行控制能力;2015年Volkow等人基于成瘾和肥胖问题提出冲动性的“NOW”和“LATER”系统。“NOW”系统主要与立即奖励有关,包括腹内侧前额皮层和伏隔核(NAcc),而“LATER”系统主要与延迟奖励有关,主要包括背外侧前额皮层、内侧前额皮层、前扣带回和尾状核[53]。两种神经模型均揭示了冲动控制过程中的动态变化,即控制系统和奖赏系统的平衡问题,如果控制系统占优势,则超重/肥胖个体可以维持或减轻体重,而如果奖赏系统占优势,则超重/肥胖个体更易受美味食物的诱惑,进而过度进食。
通过对以往文献的梳理发现,超重/肥胖会对个体的执行控制能力产生不良的影响,即超重/肥胖个体执行控制能力存在普遍下降。脑影像学证据显示超重/肥胖青少年控制相关脑区的活动减弱,而奖赏相关脑区的活动增强,该神经表征可能构成超重/肥胖形成的神经基础。值得思考的问题是:目前对超重/肥胖个体的执行控制、神经基础与其他因素的联系并不清楚,比如人格特质与超重/肥胖个体的执行控制及脑功能之间是否存在一定的关系?因此未来仍需要采用不同的技术手段、设计新颖的实验范式深入探索超重/肥胖个体执行控制普遍下降在人格、行为、认知、神经及基因分子等方面的机制。
一. 超重/肥胖对青少年冲动控制行为的影响
二. 超重/肥胖对青少年冲动控制脑功能的影响
-
Davis等人为久坐的超重儿童进行为期13周的干预,超重儿童被随机分成三组,即每天20分钟锻炼组、每天40分钟锻炼组和控制组,锻炼是以愉快与费力的游戏或运动为主,要求平均心率150以上,结果显示运动对计划得分有显著的干预效果,而且发现锻炼后超重儿童的双侧前额皮层活动有显著的增加,但是双侧后顶叶皮层活动有所减少,但是该研究并没有发现体重的变化[54]。Staiano等人探讨Exergame(一种需要大量运动的电子游戏)对超重/肥胖青少年执行控制和体重的影响,把超重/肥胖青少年随机分配到竞争组、合作组和控制组,游戏干预持续10周,研究发现竞争组被试执行控制的改善显著优于其他两组,而且执行控制能力提高的越大,体重减轻的越多[55]。Krafft等人为超重儿童进行了为期8个月的有氧锻炼(如跳绳等),结果发现有氧锻炼后超重儿童在完成Flanker任务时,其前扣带回(anterior cingulate)和额上回的激活增加,说明有氧锻炼可能改变了超重儿童执行控制的神经回路[56]。以上研究证明体育锻炼可以改善超重个体的执行控制能力达到减重的效果,而且体育锻炼可以在一定程度上增强超重/肥胖个体执行控制相关脑区功能。
-
Veling等人使用在线的食物和一般刺激Go/No-go任务,并把被试分成有节食目标组和控制组,研究发现只有节食目标组的被试接受食物Go/No-go训练后体重有显著的减少[57]。Lawrence等人探讨反应控制训练对超重/肥胖个体的食物摄入和减重情况,研究者把超重/肥胖个体随机分配到训练组和控制组,训练使用食物Go/No-go任务,控制组则使用一般刺激Go/No-go任务,每次10分钟,进行4次干预后;与控制组相比,训练组的体重有显著的减少,每日能量的摄入和对高热量食物喜爱度评定均有显著的降低,实验结果说明基于反应控制的训练可以通过降低能量摄入和减肥来改善公共健康[58]。目前神经影像学证据也支持了基于反应控制训练对体重控制的适用性,如Stice等人发现执行控制相关训练后,超重/肥胖个体接受高热量食物刺激时,不仅对高热量食物的美味度评价降低,而且其奖赏脑区的活动也有显著的降低,4周干预后超重/肥胖个体的体脂(Body Fat)有显著减少[59]。
-
正念是个体有意识地把注意维持在此时此刻的体验上,但不对其做任何判断的一种调节方法[60]。正念冥想是一组以正念技术为核心的冥想联系方法,强调全身心地活在当下,关注此时此刻的体验,是一种自由开放的意识关注过程,倡导以开放的态度主动关注痛苦体验。正念冥想较多运用到情绪、执行控制等研究中。近年来,正念冥想也逐渐运用到饮食和体重控制的研究中。例如,Kristeller等人研究发现,正念冥想干预后,超重/肥胖个体的暴饮暴食行为有显著改善,而且冥想练习次数越多,体重减少则越多[61]。O'Reilly等人系统综述了正念冥想对肥胖相关饮食行为的影响,研究发现正念冥想对暴饮暴食、情绪性进食和外部性进食均有较好的干预效果[62]。最近的研究也证明正念冥想干预可以达到减重,减少食物渴求和情绪性进食的效果[63]。在超重/肥胖青少年群体中研究发现,正念冥想水平越高的个体则情绪性进食则越少,说明正念冥想可以帮助超重/肥胖青少年对情绪困扰产生更多的适应性反应,有助于他们养成更加健康的饮食行为[64]。
-
经颅直流电刺激(transcranial direct current stimulation, tDCS)是一种在大脑中应用微电流的工具,能够调节认知脑功能[65]。tDCS可以改善执行控制能力,所以较多研究使用tDCS刺激执行控制相关脑区以改善饮食行为和减重。Ljubisavljevic等人使用tDCS连续5天刺激超重和正常体重年轻人右侧dlPFC,每次20分钟,研究发现单次刺激也可降低状态食物渴求感,连续5天可以显著降低特质性食物渴求,干预的效果可以持续到实验结束后的30天[66]。最近的研究也证明了tDCS对食物渴求和饮食的干预效果[67]。
经颅磁刺激(Transcranial Magnetic Stimulation, TMS)也逐渐运用到饮食和体重控制的研究中。例如,TMS刺激肥胖被试的左侧DLPFC,刺激持续2周,并进行了2周的效果追踪,研究发现4周后,与sham组相比,TMS组被试体重减少的较多,并且TMS组被试BMI降低的幅度也较大。说明TMS可能是减肥的有效干预方法[68]。深部TMS(deep TMS, dTMS)越来越多运用到病态肥胖的减肥研究中,如,Ferrulli等人分别使用高频(18Hz)和低频(1Hz)dTMS对肥胖病人进行减肥治疗,发现高频dTMS有显著的减肥效果[69]。
-
基于互联网平台的网络在线干预方法具有方便和快捷等特点。以往研究已经证明网络在线干预方法可以有效干预现实生活中的能量摄入和体重控制[57-58]。Stice教授团队于2012年基于认知失调理论开发了针对身体意象的网络干预平台(ebody),其在身体意象方面的干预效果已得到初步验证[70]。陈红教授团队于2016年与Stice教授团队合作对ebody项目进行汉化(http://www.ebodyproject.cn/),且在身体意象方面也发现了显著的干预效果[71]。
一. 体育锻炼
二. 基于执行控制的认知训练
三. 正念冥想训练
四. “物理刺激”
五. 网络在线干预
-
目前,超重/肥胖对个体执行控制能力影响的研究大多数采用的横向研究,缺乏对超重/肥胖个体执行控制能力和脑功能的多时间点的长期纵向研究。目前的研究证据仅支持“超重/肥胖-执行控制能力-脑功能”的相互影响关系[6]。肥胖个体奖赏相关脑区更大激活,暗示将有更高的肥胖风险,然而控制能力较强的个体则会减少更多体重[48],但是体重增加是否也可以影响大脑控制和奖赏脑区的激活这一问题目前仍未解决,未来可以从长期纵向的研究角度试图寻找答案。如对超重/肥胖和正常体重个体开展连续多年的纵向研究,采集多个时间点数据,探讨随体重变化的大脑控制和奖赏脑区活动变化情况。与控制组相比,手术治疗减肥后的个体表现更大的Stroop效应,而且转换条件下的反应时更大[72],说明手术减肥后并没有显著改善其执行控制能力,也暗示了执行控制能力在减肥中的重要性,但是如果提高超重/肥胖个体的执行控制能力,超重/肥胖个体是否可以成功减肥,执行控制能力和超重/肥胖间是否存在因果关系。多时间点的长期纵向研究则可以将个体的体重变化和执行控制建立函数关系,进一步确立两者的关系。
-
目前关于超重/肥胖对执行控制影响的神经机制研究,大多数采用的是单一模态。自Ives等人于1993年提出融合EEG和fMRI两种模态后[73],多模态研究逐渐成为未来研究的趋势。fMRI具有高空间分辨率的优势,可以定位毫米分辨率的大脑区域激活。但是fMRI测量的是间接的神经活动,而且时间分辨率受限于血氧动力学反应。EEG具有高时间分辨率的优势,使其成为对神经信号随时间变化测量的最佳技术之一[74]。同步EEG-fMRI兼有EEG的高时间分辨率和fMRI的高空间分辨率。未来研究可以通过EEG-fMRI的融合技术,更加深入探索超重/肥胖对个体执行控制影响的神经生理学机制。
-
目前采用的多种干预方法中存在一个共同的目标,即提高超重/肥胖个体的执行控制能力,以期达到体重控制和减肥的效果。然而,青少年时期是执行控制能力快速发展时期,青少年的执行控制和大脑发育仍不成熟,青少年的超重/肥胖问题有其独特的特点。虽然体育锻炼、认知训练、正念冥想、物理刺激和网络干预对超重/肥胖问题的干预都有一定的效果,且得到实证研究的支持[55, 57, 63, 69],但是目前并没有专门针对青少年肥胖问题的特定干预方法。青春期是执行控制能力快速发展的关键时期,也是大脑的快速发育时期,青春期身体和大脑均有剧烈的变化[75]。所以,目前的干预方法不一定完全适合青少年,未来可以进行多种干预技术相结合的研究,以期探索适合青少年超重/肥胖问题的最佳干预方法。例如,利用ebody项目优越性和其他干预方法的广泛适用性,我们未来可能将ebody项目与其他干预方法相结合来探索解决青少年超重/肥胖问题的最佳方法。




 下载:
下载: