-
杜鹃是我国十大名花之一, 被喻为“花中西施”, 自古有“花中此物为西施, 芙蓉芍药皆嫫母”的佳句[1], 具有极高的观赏及园林应用价值.桃叶杜鹃(Rhododendron annae)为杜鹃花科杜鹃花属常绿灌木, 冠形优美, 花色丰富, 花期集中于5, 6月木本少花季节, 主要分布于贵州的高山地区, 花色艳丽, 观赏价值极高[2], 但桃叶杜鹃为浅根系树种, 耐旱性较差, 严重阻碍其引种栽培及在园林中的应用.杜鹃花类菌根(ericoid mycorrhizas, ERM)是指杜鹃花科(Ericaceae)几个属植物的根系在自然生境中形成一种特殊类型的内生菌根共生体, 具有促进和改善宿主植物营养元素的吸收、促进宿主植物生长以及增强宿主植物对逆境环境的适应性等作用[3-4], 是杜鹃花科植物全球广泛分布的重要原因.现已证实接种ERM真菌可以促进氮源的吸收[5], 在不同的氮源培养基上, 接种ERM真菌能增加云锦杜鹃对氮源的吸收, 特别是促进硝态氮和有机氮的吸收[6].ERM菌株对锦绣杜鹃[7]、桃叶杜鹃[8]和毛棉杜鹃[9]等有明显的促生效应, 可以提高杜鹃“淡妆”的抗热性[10]和毛棉杜鹃幼苗干旱胁迫的适应性[11].
植物激素作为植株内重要信号分子, 在调节植物的生长发育和对外界环境的响应过程起十分重要的作用.研究表明:外源植物激素有利于增强植物的生理活性、提高植物的抗逆性[12-13].干旱胁迫下, 植物生长受到抑制, 内源激素生长素(indole-3-acetic acid, IAA)、赤霉素(Gibberellin A3, GA3)和玉米素核苷(trans-Zeatin-riboside, ZR)合成受阻, 含量呈下降变化, 使植株生长速率减慢, 以缓解水分不足对植株完成正常生理活动的压力[14-16]; 脱落酸(abscisic acid, ABA)作为逆境信号因子则迅速累积, 在根部快速合成大量ABA并通过木质部蒸腾流将ABA输送到地上部分参与叶片气孔调节, 降低气孔导度, 减少蒸腾失水提高植株的保水能力[17].接种菌根真菌能显著增加植株IAA, ABA, GA3, ZR的质量比、改变其平衡状况[18], 增强干旱胁迫下的内源激素调节能力, 促进植物碳素和矿质营养元素代谢, 改善植物营养状况, 增强植物抗逆性[19].现已证实接种ERM真菌对桃叶杜鹃有明显的促生效应[8]; 干旱胁迫下ERM真菌能提高桃叶杜鹃生理效应和光合效应[20-21], 但ERM真菌如何通过内源激素来影响桃叶杜鹃抗旱能力还不清楚.
本试验以接种2株ERM真菌对桃叶杜鹃进行持续干旱试验, 研究持续干旱下ERM真菌对桃叶杜鹃内源激素的影响, 从内源激素的方向揭示ERM真菌与桃叶杜鹃抗旱能力的关系, 为促进桃叶杜鹃及常绿杜鹃的引种栽培、园林应用提供理论依据.
全文HTML
-
PDA培养基:马铃薯200.0 g, 葡萄糖20.0 g, 琼脂粉20.0 g, 蒸馏水1 000.0 mL, 121 ℃条件下高温高压蒸汽灭菌20 min.
菌株:2个供试菌株:TY29(AB158314:Trametes ochracea)和TY35(AB378554:Pochonia bulbillosa)(括号中前者为国际GenBank中的登录号, 后者为与试验菌株亲缘关系最近种)是从桃叶杜鹃根系分离的优良备选菌株[8].将2个供试菌株(TY29, TY35)进行平板培养, 接种后置于25 ℃培养箱中黑暗培养2周, 待菌丝长满基质后作为菌剂使用.
供试桃叶杜鹃种子:育苗所用种子于2015年11月采自贵州省百里杜鹃风景区方家坪.播种前种子经0.5% KMnO4溶液中消毒15 min, 再用无菌水漂洗10次.选生长势和苗木大小基本一致的幼苗参加试验.
培养基质:育苗基质采自百里杜鹃风景区桃叶杜鹃林下腐殖质土.pH值为4.77, 有机质为44.15 g/kg, 全氮为1.56 g/kg, 全磷为0.161 g/kg, 有效磷为7.04 mg/kg, 碱解氮为268.55 mg/kg, 速效钾为205.91 mg/kg.
-
2015年12月进行桃叶杜鹃播种.育苗基质用腐殖土和珍珠岩按照体积比为3:1的比例配制, 在121 ℃条件下高温高压蒸汽灭菌20 min, 自然冷却后于80 ℃条件下烘干2 h.桃叶杜鹃种子细小, 千粒质量为(0.206±0.001) g.将籽粒饱满的桃叶杜鹃种子及播种花盆(上口径×底径×高度为21 cm×15 cm×18.5 cm)在0.5% KMnO4溶液中消毒15 min, 用蒸馏水冲洗至无色、晾干.在消毒后的花盆中装入2/3高度的灭菌基质, 均匀地铺上长满菌丝的PDA培养基, 在菌丝上覆盖少量基质并将消毒后的种子均匀播撒其上, 播种完毕用剪细并灭菌后的松针进行均匀覆盖放入人工气候箱内恒温培养(温度25 ℃、湿度85%、光照24 h).
-
待幼苗出土生长120 d后, 将以上各接种处理移出人工气候箱, 移栽到用0.5% KMnO4浸泡10 min消毒清洗后的塑料花盆中(上口径×底径×高度为11 cm×8.7 cm×10 cm), 每盆1株, 放置贵州大学林学院苗圃大棚内进行菌根苗培育、管理.
-
采取随机区组试验, 试验设计2个接种处理(TY29和TY35), 1个对照CK(不接菌), 每处理20盆, 每盆1株, 每处理重复3次.2016年7月选取各处理生长一致的1年生桃叶杜鹃菌根苗, 统一浇水管理一个月后采用自然干旱方式进行胁迫处理.干旱胁迫前, 将栽培基质浇至饱和持水量, 置于温室大棚内模拟自然干旱, 使水分不断消耗.在持续干旱当天(0 d)和持续干旱的第4 d、第8 d和第12 d进行内源激素含量测定, 同时在干旱胁迫的第12 d对苗木进行复水, 并在复水4 d后进行内源激素含量测定.采用烘干称重法对土壤进行相对含水量测定, 测得第0 d、第4 d、第8 d和第12 d土壤相对含水量分别为85.7%, 59.57%, 27.62%和13.6%.
-
桃叶杜鹃内源激素采用酶联免疫吸附检测法(ELISA)进行测定, 参照Yang Y M方法进行[22].每个处理叶片取样部位为顶芽向下第4或第5片成熟功能叶、根系取样部位为须根, 取样时迅速称取0.5 g叶片、0.1 g根系进行液氮速冻30 min, 放入-20 ℃冰箱中进行低温保存, 每个处理重复3次, 待全部取样完成后统一测定(样品送中国农业大学进行测定).
-
采用Execl 2010记录数据及绘图, 使用SPSS 20.0软件进行统计分析, 采用单因素方差分析和Duncan多重比较法进行方差检验分析.
1.1. 试验材料
1.2. 试验设计
1.2.1. 播种及接菌处理
1.2.2. 桃叶杜鹃菌根苗培育
1.2.3. 试验设计
1.3. 测定方法
1.4. 数据处理
-
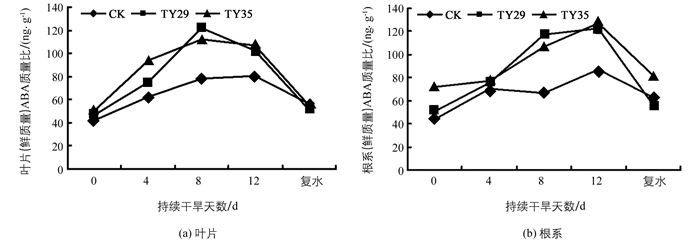
IAA是促进植物生长发育的激素.由图 1可见, 持续干旱下, 桃叶杜鹃IAA的质量比呈升高变化, 复水后IAA呈下降变化, 差异具有统计学意义(p<0.05).在正常水分条件下(第0 d), 接菌处理桃叶杜鹃叶片、根系IAA的质量比均高于CK, 在第4 d和第8 d, TY35叶片及根系IAA的质量比变化较第0 d变化不大, CK和TY29叶片及根系IAA的质量比呈增加变化, 第12 d时, CK根系IAA的质量比下降, 较第8 d下降了27.58%, TY29叶片IAA的质量比迅速下降, 较第8 d下降了24.37%, TY35叶片及根系IAA的质量比呈迅速增加, 分别较第8 d增加了35.19%和26.48%, 说明此时干旱严重影响了CK组根系的正常生理活动, 而ERM菌株能保持较高的生理活动, 以TY35的表现为最好.复水后, 桃叶杜鹃叶片和根系IAA的质量比均有所降低, 根系IAA的质量比恢复至接近正常水分条件下的含量.
-
ABA作为一种逆境信号因子, 是逆境条件下重要的调节物质.由图 2可见, 持续干旱下, 桃叶杜鹃ABA的质量比迅速累积, 复水后ABA的质量比下降, 接种ERM菌株显著高于CK, 差异具有统计学意义(p<0.01).在正常水分条件下(第0 d), 桃叶杜鹃叶片ABA的质量比差异不大, TY35根系ABA的质量比显著高于CK和TY29, 随着胁迫加剧, 叶片和根系ABA的质量比迅速增加并在第8 d和第12 d维持在较高水平, 以第8 d增幅最大, TY29和TY35叶片和根系ABA增幅分别为62.13%, 18.97%和55.62%, 38.12%.随着干旱胁迫的加剧, 接种ERM菌株较CK能迅速累积桃叶杜鹃ABA进行生理调节, 表现出较强的抗旱调节能力.复水后, 桃叶杜鹃ABA的质量比迅速下降, 叶片和根系ABA的质量比基本恢复到正常水平, 表明桃叶杜鹃能承受短期的持续干旱, 表现出较强的干旱适应能力.
-
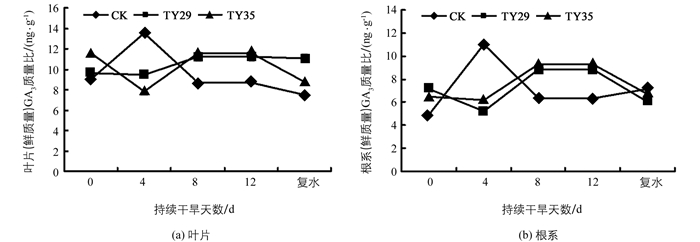
GA3是促进植物生长发育的植物激素.持续干旱下, 不同处理的桃叶杜鹃GA3的质量比呈不同变化.由图 3可见, 在正常水分条件下(0 d), 接种ERM菌株桃叶杜鹃叶片及根系GA3的质量比高于CK, 差异具有统计学意义(p<0.01).随着胁迫持续, CK在第4 d时GA3的质量比迅速升高, 在第8 d和第12 d呈下降变化, 叶片和根系GA3的质量比在第4 d分别增加了49.7%, 126.1%, TY29和TY35 GA3的质量比在第4 d有所下降, 在第8 d和第12 d呈升高变化, 且接菌处理叶片及根系GA3的质量比均高于CK, 差异具有统计学意义(p<0.01), 可能是ERM菌株对土壤水分变化适应后的结果.复水后, CK较复水前变化不大, TY29根系GA3的质量比下降, TY35叶片及根系GA3的质量比均下降, 不同处理在持续干旱下的不同表现说明不同ERM菌株对持续干旱有不同的适应方式.
-
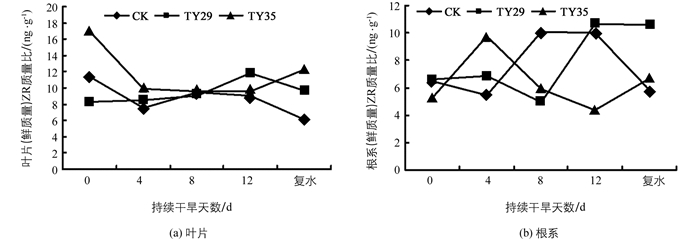
ZR为高等植物体内主要并可转运的细胞分裂素之一, 其含量变化也是植物应对干旱胁迫的重要生理措施.由图 4可见, 持续干旱下不同处理的桃叶杜鹃ZR的质量比呈现不同变化, CK和TY29呈升高变化, TY35呈下降变化, 差异具有统计学意义(p<0.05).在正常水分条件下(第0 d), TY35的ZR的质量比远高于CK和TY29, 其中叶片ZR的质量比分别较CK和TY29增加49.0%和103.68%.随着干旱持续, CK和TY29叶片ZR的质量比变化不大, 根系ZR的质量比呈升高变化, 以第12 d的ZR的质量比为最高; TY35的叶片ZR的质量比呈下降变化, 以第4 d时41.7%的降幅为最大, 根系ZR的质量比在第4 d增加85.55%, 在第8 d和第12 d随着土壤含水量的减少呈下降变化, 在第12 d分别较CK和TY29下降了56.15%和58.92%.复水后, CK叶片和根系ZR的质量比下降并低于正常水分条件下的含量, TY29与复水前变化不大, TY35较复水前增加, 表明接种ERM菌株在干旱胁迫解除后有利于桃叶杜鹃ZR的恢复.
-
干旱胁迫下, 植物是通过多种激素共同调节作用的.由表 1可见, 持续干旱下IAA/ABA, ZR/ABA和(IAA+ZR+GA3)/ABA比值呈下降变化, 其中ZR/ABA比值急剧下降, 复水后, IAA/ABA, ZR/ABA和(IAA+ZR+GA3)/ABA比值呈升高变化.持续干旱下, CK组IAA/ABA, ZR/ABA和(IAA+ZR+GA3)/ABA比值均高于接菌组, 差异具有统计学意义.在第12 d时, TY29和TY35的IAA/ABA比值分别低于CK 31.05%和34.93%, ZR/ABA比值分别低于CK 12.28%和47.37%, (IAA+ZR+GA3)/ABA比值分别低于CK 26.57%和14.91%.复水后, 各处理IAA/ABA, ZR/ABA和(IAA+ZR+GA3)/ABA比值均有不同程度回升, 以TY35处理的IAA/ABA, ZR/ABA和(IAA+ZR+GA3)/ABA比值增幅最快, 较复水前分别增加了91.93%, 130%和46.35%, 说明干旱胁迫解除后, TY35有较强的激素综合调节恢复能力.
2.1. 持续干旱下ERM菌株对桃叶杜鹃IAA的影响
2.2. 持续干旱下ERM菌株对桃叶杜鹃ABA的影响
2.3. 持续干旱下ERM菌株对桃叶杜鹃GA3的影响
2.4. 持续干旱下ERM菌株对桃叶杜鹃ZR的影响
2.5. 持续干旱下ERM菌株对桃叶杜鹃IAA/ABA、ZR/ABA、(IAA+ZR+GA3)/ABA比值影响
-
逆境条件下, 植物通过激素水平的变化来调节其生理机能和生长节律以适应逆境.秦双双[23]、贾瑞丰等人[24]的研究表明干旱胁迫下植株体内IAA的质量比总体呈下降变化, 何卫军[25]、王霞等人[26]的研究表明不同的品种或材料对干旱胁迫下IAA的响应方式不同.本研究结果表明:ERM菌株显著增加桃叶杜鹃IAA的质量比, 随着胁迫持续, IAA的质量比呈增加变化与赵文魁[27]、敖红等人[16]的研究结果相似; 在重度胁迫时桃叶杜鹃根系IAA的质量比呈下降变化可能是桃叶杜鹃通过降低生长来主动防御干旱, 而接种ERM菌株桃叶杜鹃根系IAA的质量比达到最大值, 可能是菌根共生体通过菌丝网络扩大根系吸收面积缓解干旱带来的伤害, 维持较高的IAA水平来主动增强根系吸收能力, 从而增强桃叶杜鹃的抗旱能力.
ABA是植物体内最重要的逆境信号激素, 可作为信号分子诱导和启动逆境防御反应, 提高植物体内保护酶的活性, 降低膜脂过氧化程度, 保护膜结构的完整性, 增强植物逆境胁迫下的抗氧化能力[28].持续干旱下, 桃叶杜鹃ABA的质量比迅速累积, 随着胁迫加剧, 接种ERM菌株桃叶杜鹃迅速增加根系和叶片ABA的质量比, 在重度干旱时根系和叶片ABA的质量比均保持在较高水平, 可能是菌根共生体为了应对干旱通过根系合成大量的ABA运输至叶片来启动逆境防御反应, 提高保护酶活性, 降低膜脂过氧化程度, 同时高的质量比的ABA有利于调节叶片气孔运动来减少水分散失, 增强桃叶杜鹃的保水能力和同化能力.
GA3是促进植物生长发育一类的激素, 具有促进种子发芽和植物生长、提早开花结果等作用.干旱胁迫对GA3影响结论不一, 韩瑞宏等人[29]对紫花苜蓿研究表明GA3的质量比呈下降变化, 敖红等人[16]对云杉的研究表明干旱对GA影响不明显.持续干旱下, 桃叶杜鹃GA3的质量比随胁迫呈增加降低变化, 与贾瑞丰等人[24]的研究结果相似, 接种ERM菌株桃叶杜鹃GA3的质量比呈降低升高变化.吴玉香等人[30]证实在一定范围内, GA3能提高西洋杜鹃的SOD活性, 降低MDA含量的生成.在重度干旱胁迫下, 接菌处理叶片及根系GA3的质量比均高于CK, 差异具有统计学意义(p<0.01), 有助于提高桃叶杜鹃SOD活性, 降低细胞膜的受伤害程度, 维持桃叶杜鹃对干旱的耐受性.
ZR可以促进细胞分裂, 影响根系发育, 延缓叶片衰老, 与植物抗逆性密切相关.汤章城[31]认为生长素可以降低根系对水分的透性, 减少气孔阻力, 因此胁迫期间ZT含量的降低, 减少了细胞分裂, 不利于叶片的伸长, 但有利于植物保持较高的水分状态, 是一种保护性的生理反应[32].持续干旱下, 各处理桃叶杜鹃叶片ZR的质量比呈下降变化, 可能是为了降低叶片细胞生命活动来降低水分消耗, 提高水分利用效率; 不同处理的桃叶杜鹃根系ZR的质量比呈现不同的变化可能是不同菌株对干旱胁迫的影响方式不同, CK和TY29可能是根系受到干旱胁迫后改变ZR的质量比来影响根系发育的结果, TY35可能是通过降低根系ZR的质量比来减慢生长速率, 降低水分消耗提高水分利用率缓解干旱造成的压力, 从而提高杜鹃杜鹃的抗旱能力.
-
干旱胁迫下, 植物是通过多种激素共同调节作用的.持续干旱下桃叶杜鹃IAA/ABA, ZR/ABA和(IAA+ZR+GA3)/ABA比值呈下降变化, 其中ZR/ABA比值急剧下降, 接菌处理比值显著低于CK.这种干旱胁迫下激素互作的变化在很多研究中得到了证实[33-34].干旱胁迫下, 多数植物生长促进型激素(IAA, GA3, ZR)含量呈下降变化, 生长抑制型激素ABA升高, 植物通过减缓生长、促进气孔关闭、降低蒸腾等生理活动来降低水分的消耗, 以主动、互作和协调的形式来响应干旱胁迫, 降低干旱对植株的伤害.接菌处理比值显著小于对照组表明ERM菌株对桃叶杜鹃有更强的干旱调节及抗旱能力.复水后, IAA/ABA, ZR/ABA和(IAA+ZR+GA3)/ABA各比值都有不同程度的回升, 进一步证实在干旱胁迫及胁迫解除后植物是通过多种激素共同互作、共同调节作用的.
综上所述:ERM菌株增加桃叶杜鹃IAA, ABA, GA3, ZR的质量比, 随着干旱胁迫的持续及加强, 接种ERM菌株迅速累积并维持桃叶杜鹃较高的ABA的质量比来诱导防御基因的表达、保护酶活性增加、增强气孔运动调节, 提高IAA, GA3, ZR的质量比增强根系主动吸收能力和SOD活性来降低干旱带来的伤害, 表现出较强的抗旱能力.




 下载:
下载: