-
云南石林地处中国西南山脉片区,分布于云南省昆明市石林县境内,其间拥有众多的岩溶地貌,地理位置是24°30′-25°03′ N,103°10′-103°40′ E,海拔1 600~1 950 m,属亚热带低纬度高原山地季风气候,年平均气温约16 ℃[1].云南石林位于中国西南喀斯特地区,是典型的喀斯特地貌,以其连续分布面积大(超过900 km2)、发育类型齐全、景观秀丽和生态环境脆弱而著称于世[2-3].云南石林的喀斯特地貌由于其脆弱的地质背景和不合理的人为活动,导致了地上植被消失,岩石裸露,极易导致石漠化,给社会带来巨大的损失[4-6].
石林由碳酸盐岩、白云岩和CaCO3含量较高的石灰岩组成[7],岩石作为特殊的生存环境,随环境条件变化产生巨大的波动(包括太阳辐射、干旱、营养缺乏和温度波动等),各种微生物以其特殊的生存方式在岩石的表面和内部存活.数量巨大的微生物作用于岩石的表面和内部,参与了喀斯特地区演化的过程,特别是生物圈岩石和矿物的风化以及土壤的形成过程等[8].
研究表明,微生物可能通过两种方式加速风化碳酸盐岩,包括直接与岩石接触或者自身分泌活性物质(如酶)[9].根据曹成亮等对放线菌的矿物转化作用研究发现[10],石生放线菌驱动了CaCO3分子重组,重结晶,对于碳酸盐矿物的生物转化有重要的作用.此外,岩石上的石生放线菌还能导致碳酸盐的结构被破坏,造成这种现象的原因是岩石表面由于微生物作用吸收不同的太阳辐射,从而改变岩石晶体局部结构,甚至造成一些建筑物的损伤.因此,对石生放线菌的研究不仅可以为我们了解放线菌多样性提供便利,丰富的放线菌资源还可以对建筑物和石质文物的保护提供重要的理论依据与技术支持.另外,绝大部分的医用抗生素都是由放线菌产生(如链霉素(streptomycin)、土霉素(oxytetracycline)等)[11].
目前,关于石漠化地区微生物的特性已有一定的研究,但却缺少对石林石漠化地区石生放线菌多样性的研究.本研究以石林石漠化地区岩石为材料,采用纯培养技术、形态学和16S rDNA序列对石生放线菌进行初步的分离鉴定,研究石生放线菌的多样性,为研究微生物对碳酸盐岩的风化成土过程及喀斯特地区石漠化的治理提供理论依据.
全文HTML
-
岩石样品采自云南省石林县石林石漠化地区带有不同颜色微型菌落的岩石(图 1),在不同的环境条件下,随机选取8~10个样点,每个样点随机取样4~5份,总计挑选40份岩石作为研究样品.为了防止样品被采样工具污染,每次采样前用75%乙醇冲洗小锤3次.将采集好的岩石样品与附着的微型菌落一起装入无菌袋中密封保存,带回实验室,然后保存于4 ℃冰箱中备用.
-
高氏一号培养基:可溶性淀粉20 g,KNO3 1 g,FeSO3·7H2O 0.01 g,K2HPO4 0.5 g,MgSO4 0.5 g,NaCl 0.5 g,琼脂18~20 g,蒸馏水补足1 000 mL,pH值为7.4~7.6,121 ℃,0.12 MPa灭菌30 min.
-
材料处理:采用土壤稀释涂布平板法[12],将可能含有放线菌的岩石置于高温高压灭菌的培养皿中,用无菌水和95%乙醇重复清洗以祛除表面的污垢,用切石器将岩石样品凿成细小的岩片,将其放入装有适量玻璃珠并盛有99 mL无菌水的锥形瓶内,充分摇匀,浸泡片刻后进行梯度稀释(用无菌移液枪吸取10-2悬液1 mL,吹入9 mL无菌水中即为10-3,如此重复2次,可制成10-4,10-5的稀释液).分别吸取浓度为10-2,10-3,10-4和10-5悬浮液100 μL滴在高氏一号培养基上,用涂布器进行涂布,温度为28.5 ℃,培养时间为3~4 d. 1)划线分离:培养3~4 d待长出一定量的菌丝后,用接种环从培养后长出的单个菌落分别挑取少许菌苔,在高氏一号培养基平板中划线分离. 2)培养:划线完毕后盖上培养皿盖,平板倒置,28.5 ℃培养3~4 d,观察菌落的生长情况,检查是否有杂菌掺杂,发现杂菌后不断进行分离与纯化直到获得纯的菌株.从中挑选1株单一菌株,用砂土管法保存在4 ℃的冰箱中备用.
-
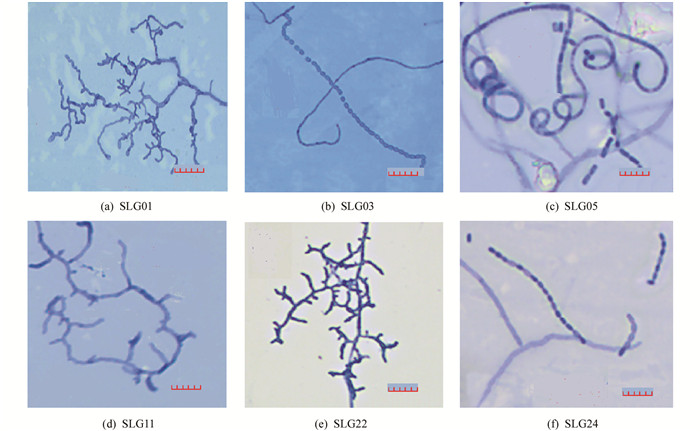
石林石生放线菌形态观察采用插片法进行观察[13].将分离获得的石生放线菌使用点接种法接种于高氏一号培养基上,用无菌盖玻片倾斜45°插在距离菌种1 cm左右的位置. 28.5 ℃暗培养,待菌丝生长至盖玻片1/2时取出盖玻片.置于显微镜下观察菌丝、孢子等形态结构,并用电子显微镜进行拍照.参照《放线菌系统学——原理方法及实践》[14]及《常见细菌系统鉴定手册》[15],对放线菌的形态展开观察鉴定.
-
采用酶解法[16]小量提取菌株的DNA,稍作改变,步骤如下:
1) 将约480 μL的含有溶菌酶30 μL的1×TE溶液(溶菌酶的终质量浓度为4 mg/mL)加入到装有50 mg菌体的离心管中,然后放入37 ℃摇床12 h.
2) 加入5 μL质量浓度为20 μg/mL蛋白酶K和50 μL 20%SDS震荡混匀1 min,55 ℃水浴45~60 min.
3) 加550 μL苯酚、氯仿、异戊醇溶液,比例为25:24:1,震荡混匀,12 000 r/min低温离心10 min,吸取上清液(不要吸到中间部分).
4) 往上清液中加入50 μL 3 mol/L乙酸钠(pH值为4.8~5.2)混合加入500 μL异丙醇后,放入-20 ℃冰箱2 h.
5) 12 000 r/min低温离心10 min,去除上清液,加入200 μL 70%乙醇轻摇2次,12 000 r/min低温离心5 min,弃乙醇.
6) 37~55 ℃干燥后加入50 μL 1×TE溶解DNA(视DNA量而定),-20 ℃保存备用.
-
引物选择,27F(正向引物):5'-AGAGTTTGATCCTGGCTGAG-3';1492R(反向引物):5'-TACGGCTACCTTGTTACGACTT-3',引物由生工生物科技有限公司提供.扩增体系为50.0 μL:10× PCR Buffer为5.0 μL;MgCl2为5.0 μL;dNTP为1.0 μL;模板DNA为2.0 μL;27F为1.5 μL;1492R为1.5 μL;双蒸水补充至50.0 μL. PCR扩增程序:94 ℃预变性4 min;94 ℃变性1 min;55 ℃退火30 s;72 ℃延伸2 min;共30个循环. 72 ℃延伸2 min,-20 ℃保存.
把4.0 μL PCR扩增后的产物和10×上样缓冲液混合,然后用1%琼脂糖凝胶进行电泳检测,将检测合格的PCR扩增产物送生工生物科技有限公司测序.从公司测得的序列通过Sequencher 4.14软件进行拼接,将拼接好后的序列在http://www.ncbi.nlm.nih.gov/中将菌株的16S rDNA序列与GenBank数据库中的序列进行同源性比对,运用软件MEGA 6.06构建Neighbor-Joining系统发育树,用自展法检测1 000次数据集,然后根据系统发育树中组群间的亲缘关系对石生放线菌菌株进行分类,判定其种属关系.
-
分离率(Isolation rates,IR)是指从样本组织块中得到的菌株数与全部样本组织块数的比值,用来衡量石生放线菌的丰富程度;相对分离率(Relative ferquency,RF)是指从样品中分离到的某一种放线菌的株数占分离到的总菌株数的百分率,用来衡量石生放线菌某种放线菌的优势度.
-
Shannon-Weiner指数可以反映每一份样品所含放线菌的物种多样性程度.按Shannon-Weiner指数计算[19],若Shannon-Weiner指数数值越大,说明石生放线菌的多样性越高.
式中,Pi表示第i种石生放线菌的数量占该生境中全部放线菌菌株总数的比例.
1.1. 岩石样品
1.2. 培养基
1.3. 放线菌的分离纯化及保存
1.4. 放线菌形态学观察
1.5. 石生放线菌DNA抽提及PCR扩增
1.5.1. 石生放线菌DNA提取
1.5.2. PCR扩增及测序[17]
1.6. 分离率及多样性指数
1.6.1. 分离率与相对分离率[18]
1.6.2. 多样性指数(H′),即Shannon-Weiner指数
-
采用高氏一号培养基对石林石生放线菌进行分离纯化,共分离得到65株石生放线菌,所用岩石块数为40块,计算出分离率达到162.50%,种数为11种.基于以上结果,可以认为石林石生放线菌具有较高的丰富性.
-
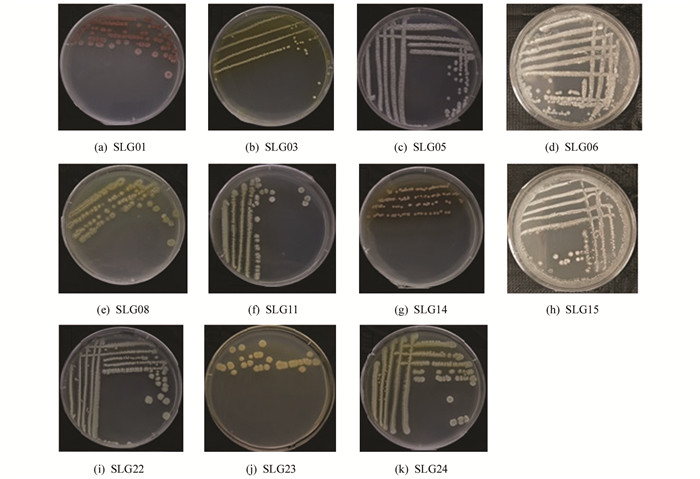
根据菌落的形态特征将分离纯化后的石生放线菌初步分离合并为11种形态型,整理合并编号为SLG01,SLG03,SLG05,SLG06,SLG08,SLG11,SLG14,SLG15,SLG22,SLG23,SLG24,根据菌落形态特征(图 2)、菌丝或孢子(图 3)及显微结构特征(表 1),初步判定SLG01,SLG08,SLG11,SLG14,SLG15,SLG22,SLG23,SLG24为链霉菌属(Streptomyces);SLG03为放线菌属(Actinobacterium);SLG05,SLG06为拟无枝酸菌属(Amycolatopsis sp).因为部分菌株形态结构特征过于相似,因此需结合分子生物学进行鉴定.
从表 1可以看出,分离的65株石生放线菌中,根据相对分离率计算方法可得到链霉菌属的相对分离率为90.76%,为优势菌群,拟无枝酸菌属的相对分离率为7.70%,放线菌属的相对分离率为1.54%.根据多样性指数计算公式,得到高氏一号培养基分离到石生放线菌的多样性指数为2.276 29,表明石林石生放线菌具有丰富的多样性.
-
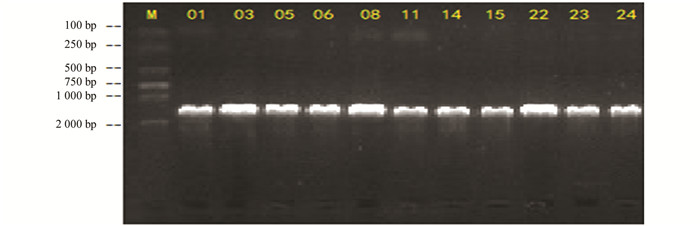
提取分离纯化后的石生放线菌DNA,检测纯度合格后采用引物27F(正向引物):5'-AGAGTTTGATCCTGGCTGAG-3';1492R(反向引物):5'-TACGGCTACCTTGTTACGACTT-3',取PCR扩增产物通过1.0%琼脂糖凝胶进行电泳检测,在凝胶成像系统中观察扩增产物条带清晰,大小均在1 500 bp左右(图 4).
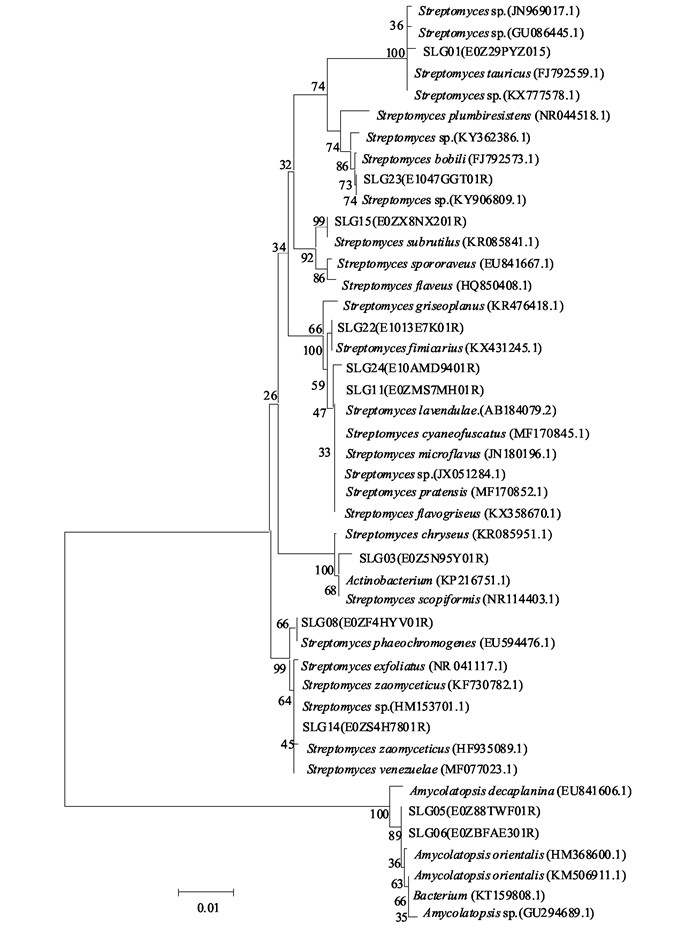
将所获11种石生放线菌16S rDNA序列在GenBank中注册,获得GenBank登录号(表 2).序列提交至GenBank进行Blast同源比对,选取同源性最高序列作为参照菌株序列.与获得的11种放线菌16S rDNA一起,运用软件MEGA 6.06构建Neighbor-Joining系统发育树,用自展法检测1 000次数据集,然后根据系统发育树中组群间的亲缘关系对石生放线菌菌株进行分类,判定其种属关系,结果见图 5.在系统发育树上,分离到的石生放线菌与聚在同一系统发育树上相应菌株的16S rDNA序列相似度在99%~100%之间.
从GenBank登录号(表 2)和系统发育树(图 5)上看,这65株菌属于1门1纲1目3科3个属11个种,SLG01为链霉菌属公牛链霉菌(Streptomyces tauricus),SLG03为放线菌属(Actinobacterium),SLG05为拟无枝酸菌属东方拟无枝酸菌(Amycolatopsis orientalis),SLG06为拟无枝酸菌属(Amycolatopsis sp.),SLG08为链霉菌属暗色产色链霉菌(Streptomyces phaeochromogenes),SLG11为链霉菌属淡紫灰链霉菌(Streptomyces lavendulae),SLG14为链霉菌属委内瑞拉链霉菌(Streptomyces venezuelae),SLG15为链霉菌属微红链霉菌(Streptomyces subrutilus),SLG22为链霉菌属粪生链霉菌(Streptomyces fimicarius),SLG23为链霉菌属(Streptomyces sp.),SLG24为链霉菌属蓝微褐链霉菌(Streptomyces cyaneofuscatus).其中,SLG03,SLG06,SLG23只能鉴定到属,其余8株菌均鉴定到种,但不能够确定其真正的种属地位,还需要进一步鉴定,链霉菌属可能是石林石漠化地区石生放线菌中的优势菌株.
2.1. 石生放线菌分离结果
2.2. 菌落形态特征
2.3. 石生放线菌16S rDNA序列PCR扩增及序列分析
-
目前石漠化已经成为西南岩溶地区生态恶化的主要因素,对石生微生物——放线菌多样性的研究,不仅可为石漠化地区生态恢复与重建提供理论依据,还可以丰富放线菌的资源.我们采用高氏一号培养基对石生放线菌进行分离培养,从岩石样品中分离共得到65株石生放线菌.因为生理生化不能完全准确到放线菌的种属,需进行分子鉴定,经16S rDNA序列同源性分析及生物学表型特征分析,结果表明分离得到的65株石生放线菌隶属于1门1纲1目3科3个属11个种.分别是SLG01为链霉菌属公牛链霉菌(Streptomyces tauricus),SLG03为放线菌属(Actinobacterium),SLG05为拟无枝酸菌属东方拟无枝酸菌(Amycolatopsis orientalis),SLG06为拟无枝酸菌属(Amycolatopsis sp.),SLG08为链霉菌属暗色产色链霉菌(Streptomyces phaeochromogenes),SLG11为链霉菌属淡紫灰链霉菌(Streptomyces lavendulae),SLG14为链霉菌属委内瑞拉链霉菌(Streptomyces venezuelae),SLG15为链霉菌属微红链霉菌(Streptomyces subrutilus),SLG22为链霉菌属粪生链霉菌(Streptomyces fimicarius),SLG23为链霉菌属(Streptomyces sp.),SLG24为链霉菌属蓝微褐链霉菌(Streptomyces cyaneofuscatus).说明石林石漠化地区石生放线菌具有丰富的多样性,其中链霉菌属为优势菌群.这些菌株对石漠化地区土壤改良和生态环境恢复等有极其重要的意义.
石林微生物群是一个庞大的菌群,石林石生放线菌仅是其中的一个代表.石林微生物多样性的研究是一项对于提高放线菌资源有利的研究,这对改善喀斯特地貌的环境,提高社会对喀斯特石漠化地区的关注具有重大的意义.为了能够更加透彻地研究放线菌对喀斯特地貌的影响,在后续工作中可就不同季节、不同地区、不同生长环境下的放线菌进行多样性研究,为喀斯特地貌研究提供数据参考,也能对石林的保护提供重要的理论与技术支持.另外,链霉菌属菌株作为一株可以产生天然活性物质的菌种(67%的医用抗生素都是由其产生),对于临床医学的研究有重要的前景[19].为了后续的研究,可以在石生放线菌解钙解镁方面做一个比较深入的研究,还可以就不同季节的喀斯特地貌石生微生物进行研究,以利于研究石生微生物的多样性,丰富石生微生物的资源.




 下载:
下载: