-
开放科学(资源服务)标志码(OSID):

-
“以药制药”应用于中医药已有十分悠久的历史,最早可追溯至东汉张仲景《金匮要略方论》中记载的阿胶经蒲黄炒后可增效、川乌经蜜制后可减毒,其是以一些药物炮制另一些药物,以达到减毒、增效/存效等效果的传统制药技术[1]. 目前可用于炮制其他药物的药物较多,如生姜、蛤蚧粉、蜂蜜、蒲黄、吴茱萸、甘草[1]. 具有调和诸药功能的甘草备受关注,其在“以药制药”领域内应用广泛,可使被炮制的药物减毒、增效/存效,如甘草制雷公藤、款冬花等[2-3].
细辛Asari Radix et Rhizoma为马兜铃科植物北细辛Asarum heterotropoides Fr. Schmidt var. mandshuricum (Maxim.) Kitag.、汉城细辛Asarum sieboldii Miq. var. seoulense Nakai或华细辛Asarum sieboldii Miq.的干燥根和根茎,为中医临床常用中药. 受“马兜铃酸肾病”的影响,其临床用药的安全性受到关注;同时大量研究表明,细辛长期大剂量服用会对肝肾等重要脏器产生毒性[4-6]. 炮制是一种能使中药减毒并存效或增效的有效方法[7],目前关于炮制对细辛成分、药效、毒性的影响报道较少,相关研究亟待加强. 有研究分析了不同炮制方法(盐制、炒焦、米泔水制、碱制、甘草制、醋制、姜制、酒制、碱醋制、蜜制)对细辛毒性成分(马兜铃酸A、黄樟醚)含量的影响,结果表明细辛炮制后,马兜铃酸A和黄樟醚的量均有不同程度的降低[8]. 据报道,细辛经碱(NaHCO3)制后,其急性毒性降低,抗炎镇痛作用增强[9]. 综上,本研究拟基于“以药制药”理念,通过急性毒性实验、长期毒性实验、大鼠硝酸甘油偏头痛模型,对细辛经甘草炮制前后的毒性、药效变化进行剖析,以提升细辛临床用药的安全性和有效性.
全文HTML
-
BS200生化分析仪,迈瑞医疗国际有限公司;352酶标分析仪,芬兰Labsystems Multiskan MS公司;Sorvall ST 40冷冻离心机,美国Thermo Fisher公司;CX22光学显微镜,日本OLMPUS公司;BP121S电子分析天平,赛多利斯科学仪器北京有限公司;RM2235石蜡切片机,德国Leica公司.
细辛购于重庆市解放路中药材专业市场,经重庆市中药研究院秦松荣研究员鉴定为马兜铃科植物北细辛Asarum heterotropoides Fr. Schmidt var. mandshuricum (Maxim.) Kitag.的干燥根和根茎. 大鼠丙氨酸氨基转移酶(ALT,批号202012)、门冬氨酸氨基转移酶(AST,批号202012)、肌酐(Cr,批号202012)、尿素氮(BUN,批号202012)生化试剂盒,上海笃玛生物科技有限公司;大鼠一氧化氮(NO,批号200739M)、一氧化氮合成酶(NOS,批号200760M)、降钙素基因相关肽(CGRP,批号200734M)、5-羟色胺(5-HT,批号200787M)、去甲肾上腺素(NE,批号200765M)ELISA试剂盒,江苏酶免实业有限公司. 苏木素(批号420699)、伊红(批号392155),美国Thermo Fisher公司. 水合氯醛(批号2018103001),成都市科隆化学品有限公司;盐酸氟桂利嗪胶囊(商品名西比灵,批号180909075),西安杨森制药有限公司;硝酸甘油注射液(批号20180522),北京益民药业有限公司.
SPF级KM小鼠130只,体质量20 ± 2 g,雌雄各半;SD大鼠90只,体质量200 ± 20 g,雌性25只,雄性65只,成都达硕实验动物有限公司,许可证号SCXK(川)2015-030,实验前适应性喂养4 d. 实验动物饲养条件:室内温度20~26 ℃,相对湿度40%~70%,12 h白天,12 h夜晚,自由进食、饮水. 实验操作符合成都中医药大学实验动物福利伦理审查委员会标准.
-
据文献[10]和2015年版《四川省中药饮片炮制规范》,取甘草片,10倍量水煎煮2次,每次45 min,合并煎煮液,浓缩至浓度约为1.5 g/mL,即得炮制用甘草汁.
-
取细辛段300 g,加入300 mL甘草汁,拌匀,闷润,待甘草汁被吸尽后,置烘箱内25 ℃烘干,即得. 在获得甘草制细辛后,将细辛生品、炮制品分别进行粉碎,过5号筛,备用. 临用时,将细辛生品、炮制品粉末用蒸馏水配制成所需浓度.
-
将130只KM小鼠随机均分为13组,雌雄各半,包括6个生细辛组(7.87,6.30,5.04,4.03,3.23,2.58 g/kg),6个甘草制细辛组(9.40,7.52,6.02,4.81,3.85,3.08 g/kg),1个空白对照组. 按30 mL/kg灌胃给药1次,给药后连续观察14 d. 空白对照组小鼠灌胃给予等体积的蒸馏水. 生细辛、甘草制细辛剂量是在预实验的基础上,按0.8组距进行设置.
-
每天早晨,对中毒反应(如烦躁、蹦跳、呼吸困难、痉挛等)进行记录,并记录各组小鼠的死亡数目,对死亡小鼠进行解剖,观察脏器是否异常. 观察14 d后,采用颈椎脱臼法将剩余小鼠处死并进行解剖,观察脏器是否异常. Bliss法计算半数致死量(LD50).
-
将50只SD大鼠随机均分为5组,雌雄各半,包括空白对照组(蒸馏水)、生细辛低剂量组(0.42 g/kg)、生细辛高剂量组(1.67 g/kg)、甘草制细辛低剂量组(0.42 g/kg)、甘草制细辛高剂量组(1.67 g/kg). 按10 mL/kg灌胃给药,每天1次,连续28 d.
-
给药后观察并记录大鼠行为、食欲、分泌物、皮毛、粪便等情况.
-
末次给药24 h后,测定大鼠体质量,腹腔注射10%的水合氯醛(3.5 mL/kg)进行麻醉,腹主动脉采血5 mL,血液4 ℃静置3 h,4 ℃下4 000 r/min离心20 min,取血清,置-80 ℃保存备用. 按生化试剂盒说明书,检测血清中ALT,AST,Cr和BUN的含量.
-
腹主动脉取血后,立即对大鼠进行解剖,观察肝肾组织的外观形状,随后对肝肾进行剥离,用滤纸轻轻擦拭干净,称质量,按公式计算各脏器系数.
式中,I肝表示肝脏脏器系数,I肾表示肾脏脏器系数,W肝表示肝脏质量(g),W肾表示肾脏质量(g),W表示体质量(g).
-
取各大鼠肝或肾的同一部位,以4%多聚甲醛固定,再经脱水、透明、浸蜡、包埋、切片,随后行常规苏木素-伊红(HE)染色,在光学显微镜下观察各组大鼠的肝肾组织病理学变化.
-
将40只SD雄性大鼠随机均分为5组,包括空白对照组(蒸馏水)、模型组(蒸馏水)、西比灵组(1 mg/kg)、生细辛组(330 mg/kg)、甘草制细辛组(330 mg/kg). 按10 mL/kg灌胃给药,每天1次,连续7 d. 末次给药30 min后,空白对照组大鼠后颈部皮下注射等量的生理盐水,其余各组大鼠后颈部均皮下注射硝酸甘油(10 mg/kg),从注射硝酸甘油起,出现双耳发红、频繁挠头和甩头等现象,表明偏头痛造模成功.
-
造模4 h后,腹腔注射10%的水合氯醛(3.5 mL/kg)进行麻醉,腹主动脉采血约8 mL,其中5 mL室温下静置20 min,4 ℃下3 000 r/min离心20 min,取血清,置-20 ℃冰箱保存,用于测定NO和NOS的水平. 另3 mL以乙二胺四乙酸二钾(EDTA-2K)作为抗凝剂,混合20 min后,4 ℃下3 000 r/min离心20 min,取血浆,置-20 ℃保存,用于测定CGRP的水平,按ELISA试剂盒说明书进行测定.
-
大鼠取血后处死,取脑组织,迅速在液氮中冷冻,称质量,按质量体积比1∶9 g/mL加入9倍体积的生理盐水,用手工玻璃匀浆器在冰浴上研磨匀浆,4 ℃下3 000 r/min离心20 min,收集上清液,-20 ℃保存,按ELISA试剂盒说明书,检测脑组织上清液中5-HT和NE的水平.
-
基于R-4.0.2程序,以Bliss法计算LD50,结果以x±s表示,采用SPSS 19.0统计软件进行统计分析. 多组间比较采用单因素方差分析,方差齐者组间两两比较采用LSD法,方差不齐者组间两两比较采用Dunnett'sT3法. p<0.05表示差异有统计学意义.
2.1. 甘草汁及细辛炮制品的制备
2.1.1. 甘草汁的制备
2.1.2. 细辛炮制品的制备
2.2. 炮制前后细辛急性毒性的测定
2.2.1. 动物分组、给药
2.2.2. 动物一般情况观察、解剖及分析
2.3. 炮制前后细辛长期肝肾毒性的测定
2.3.1. 动物分组、给药
2.3.2. 动物一般情况观察
2.3.3. 肝肾功能血液生化指标检测
2.3.4. 脏器系数测定
2.3.5. 组织病理学观察
2.4. 炮制前后细辛抗偏头痛药效的测定
2.4.1. 动物分组、给药、造模
2.4.2. 血NO,NOS和CGRP
2.4.3. 脑5-HT和NE检测
2.5. 统计分析
-
与空白对照组比较,生细辛各剂量组、甘草制细辛各剂量组小鼠在给药后不同程度上出现了烦躁、蹦跳、呼吸困难及全身痉挛等中毒症状;与生细辛组比较,甘草制细辛组开始出现上述症状的时间整体延后. 小鼠解剖后,肉眼观察各脏器,未发现明显异常. 经Bliss法计算LD50,结果表明甘草制细辛的LD50(5.69 g/kg)大于生细辛的LD50(4.83 g/kg),见表 1.
-
给药第2周,生细辛高剂量组开始出现精神萎靡、食欲不振、眼部分泌物增加等现象. 给药第3周,甘草制细辛高剂量组开始出现精神萎靡、食欲不振、呼吸困难等现象. 各组大鼠皮毛、粪便无明显异常.
-
与空白对照组比较,生细辛高剂量组的ALT,AST和BUN水平升高,差异有统计学意义(p<0.01,p<0.05);Cr水平差异无统计学意义;生细辛低剂量组、甘草制细辛低、高剂量组的ALT,AST,BUN和Cr水平差异无统计学意义. 与生细辛低或高剂量组比较,甘草制细辛低或高剂量组的ALT,AST,BUN和Cr水平差异无统计学意义,但整体来看,甘草制可以减轻细辛对肝肾功能相关指标的影响(表 2).
与空白对照组比较,生细辛低、高剂量组和甘草制细辛高剂量组的肝脏脏器系数升高(p<0.05,p<0.01),差异有统计学意义;生细辛高剂量组的肾脏脏器系数升高(p<0.01),差异有统计学意义,其余各组差异无统计学意义. 与生细辛高剂量组比较,甘草制细辛高剂量组肝脏脏器系数降低(p<0.05),差异有统计学意义;肾脏脏器系数差异无统计学意义,但有降低趋势. 与生细辛低剂量组比较,甘草制细辛低剂量组的肝脏、肾脏脏器系数差异无统计学意义,但也有降低趋势(表 3).
-
通过对各组大鼠肝组织病理学进行全面观察,发现肝细胞肿胀是各组大鼠肝组织间的主要差异性病理损伤,正常肝组织及各种肝细胞肿胀表现见图 1. 根据肝细胞肿胀的程度,将其分为Ⅰ,Ⅱ,Ⅲ和Ⅳ型,见表 4. 各组在肝细胞肿胀各分型中的动物数量分布见表 5,与空白对照组相比,生细辛组或甘草制细辛组出现肝细胞肿胀的大鼠数量及严重程度均呈增加趋势,特别是生细辛高剂量组;与生细辛低或高剂量组比较,甘草制细辛低或高剂量组出现肝细胞肿胀的大鼠数量及严重程度均呈减弱趋势.
-
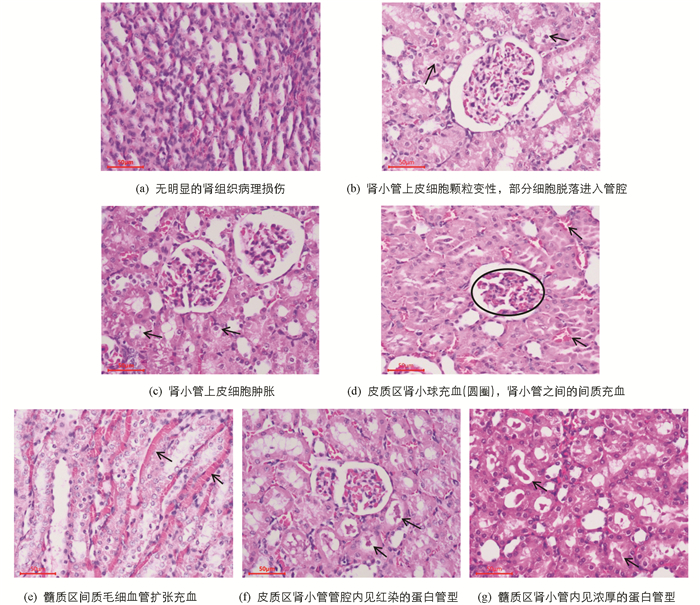
通过对各组大鼠肾组织病理学进行全面观察,发现各组大鼠肾组织间的主要差异性病理损伤包括:①肾小管上皮细胞变性/坏死:肾小管上皮细胞肿胀、颗粒变性、水泡变性,部分细胞坏死、脱落,进入肾小管管腔内;②充血:间质小静脉和毛细血管扩张充血、肾小球充血,致体积增大、肾小囊囊腔不同程度狭窄;③部分肾小管管腔内见有浓厚的深染红色的蛋白管型. 正常肾组织及各种病理损伤表现见图 2.
各组在不同肾组织病理损伤中的动物数量分布见表 6,与空白对照组相比,生细辛组或甘草制细辛组出现各肾组织病理损伤的大鼠数量呈增加趋势;与生细辛低或高剂量组比较,甘草制细辛低或高剂量组出现各肾组织病理损伤的大鼠数量呈降低趋势.
-
与空白对照组比较,模型组大鼠血中NO,NOS和CGRP水平升高,差异有统计学意义(p<0.01). 与模型组比较,西比灵组、生细辛组、甘草制细辛组大鼠血中NO,NOS和CGRP水平降低,差异有统计学意义(p<0.01). 与生细辛组比较,甘草制细辛组大鼠血中NO,NOS和CGRP水平差异无统计学意义(表 7).
-
与空白对照组比较,模型组大鼠脑组织中5-HT和NE水平升高,差异有统计学意义(p<0.01). 与模型组比较,西比灵组、生细辛组和甘草制细辛组大鼠脑组织中5-HT和NE水平降低,差异有统计学意义(p<0.01). 与生细辛组比较,甘草制细辛组大鼠脑组织中5-HT和NE水平差异无统计学意义(表 8).
3.1. 甘草制对细辛急性毒性的影响
3.2. 甘草制对细辛长期肝肾毒性的影响
3.2.1. 动物一般情况
3.2.2. 肝肾功能血液生化指标、脏器系数变化
3.2.3. 肝组织病理学变化
3.2.4. 肾组织病理学变化
3.3. 甘草制对细辛抗偏头痛药效的影响
3.3.1. 血NO,NOS和CGRP水平的变化
3.3.2. 脑5-HT和NE水平的变化
-
本研究基于“以药制药”理念,以减毒、存效/增效为目的,研究了甘草制对细辛毒效的影响. 通过急性毒性实验、长期毒性实验,以动物一般情况、LD50、肝肾功能血液生化指标(ALT,AST,Cr和BUN)、肝肾脏器系数、肝肾组织病理学变化为指标,对细辛经甘草炮制前后的毒性变化进行阐释. 基于大鼠硝酸甘油偏头痛模型,以血NO,NOS,CGRP和脑5-HT,NE水平为指标,对细辛经甘草炮制前后的抗偏头痛药效变化进行分析,结果表明甘草制可使细辛减毒存效.
LD50是表征药物急性毒性的常用指标[11]. 急性毒性实验研究显示细辛经甘草炮制后,出现毒性的时间延后,LD50增加,表明甘草炮制降低了细辛的急性毒性. 相对于急性毒性,细辛长期大剂量服用容易引起肝肾等重要脏器受损[4-6]. ALT和AST是表征肝功能的经典指标,当肝功能受损后,血液中ALT和AST水平均上升[12]. Cr和BUN是表征肾功能的重要指标,肾功能受损后,血液中Cr和BUN水平均升高[13]. 脏器系数是实验动物某脏器的质量与体质量的比值,正常状态时动物各脏器与体质量的比值相对恒定,当动物染毒后,受损脏器因充血、水肿、萎缩等原因,导致对应脏器系数发生改变,目前脏器系数是毒理实验中常用的指标[14]. 当脏器受损后,针对其进行病理组织学观察,可以直观、有效地反映出脏器受损情况,HE染色是目前最基本、应用最广泛的病理组织学染色技术[15]. 长期毒性实验研究显示细辛经甘草炮制后,出现毒性的时间延后,对肝肾功能血液生化指标(ALT,AST,Cr和BUN)、脏器系数的影响减弱;同时病理组织学结果显示,甘草制可减轻细辛对肝肾的损伤. 综上,甘草制可降低细辛的长期毒性.
2020版《中华人民共和国药典》记载,细辛具有解表散寒、祛风止痛、通窍、温肺化饮的功效,主要用于治疗风寒感冒、头痛、牙痛、鼻塞流涕、鼻鼽、鼻渊、风湿痹痛、痰饮喘咳. 研究显示,细辛善于治疗偏头痛,其在临床治疗偏头痛用药中使用频率排在第6位[16],故本研究基于大鼠硝酸甘油偏头痛模型,以血NO,NOS,CGRP和脑5-HT,NE水平为指标,考察了甘草制对细辛药效的影响. 硝酸甘油偏头痛模型支持偏头痛发病机制的三叉神经血管学说,三叉神经传出神经纤维受到刺激后释放神经肽类物质(如CGRP)作用于脑血管壁,进而引起神经源性炎症反应的发生,最终导致头痛[17-18]. NO也是一种血管活性物质,不仅可扩张脑血管,也可刺激三叉神经释放CGRP,进而引起偏头痛的发生[19]. NOS参与了NO的合成,故其在激发偏头痛和维持偏头痛持续中显得非常重要[20]. 此外,脑中5-HT和NE等的代谢紊乱也会促进偏头痛的发生[21-22]. 本研究显示,生细辛和甘草制细辛具有明显抗偏头痛的作用. 相对于生细辛,甘草制细辛的血NO,NOS,CGRP和脑5-HT,NE水平差异无统计学意义,即甘草制对细辛抗偏头痛药效没有明显影响,保持了细辛的药效.
本研究基于“以药制药”理念,通过急性毒性实验、长期毒性实验、大鼠硝酸甘油偏头痛模型,阐释了甘草制可使细辛减毒存效,可促进细辛临床用药的安全性、有效性,但其炮制减毒机制有待进一步研究.




 下载:
下载: