-
多酚氧化酶(Polyphenol oxidase,PPO,EC 1.10.3.1)是一类由核基因编码含铜质体能催化酚类物质氧化的金属酶. 最早由Yoshida在研究漆树液汁凝固现象时发现的一种活性物质,随后Keilin和Mann报道了多酚氧化酶的分离纯化方法,公布了多酚氧化酶的理化性质及酶学特征[1],开启了对多酚氧化酶的系统性研究. 国际生物化学和分子生物学联合命名委员会根据酶的催化特性将PPO分为两大类: 1) 单酚酶(EC 1.14.18.1);2) 二酚酶(EC 1.10.3),包括儿茶酚氧化酶(EC 1.10.3.1)和漆酶(EC 1.10.3.2)[2]. 目前在植物体中多酚氧化酶主要以可溶性多酚氧化酶(soluble polyphenol oxidase,sPPO)和膜结合态多酚氧化酶(membrane-bound polyphenol oxidase,mPPO)两种形式存在,其亚细胞定位在细胞质和叶绿体中[3]. 多酚氧化酶参与植物光合作用[4]、逆境胁迫[5]、抗病虫害[6]、花色形成[7]、生物组织修复[8],对植物生长发育起到了积极的作用. 目前,该酶在茶叶发酵[9]、造纸工业[10]、污水处理[11]等领域得到了广泛应用.
甘薯(Ipomoea batatas (L.) Lam)又名红薯,是我国主要粮食经济作物之一,产量居全球之首,而西南地区甘薯种植面积居全国第一. 据研究报道,甘薯潜在的营养和药用价值非常高,甘薯富含淀粉[12]、蛋白质、膳食纤维[13]、维生素[14]、酚类[15]、黄酮[16]、胡萝卜素[17],具有增强免疫力、抗氧化、抗心血管疾病和抗肿瘤等药理作用[18-20];而在工业能源方面,甘薯淀粉作为原料发酵和生产燃料酒精和酒精汽油[21],以缓解目前的能源危机. 近年来,鲜切甘薯因营养丰富、便捷以及高利用率等特点迅速得到广大消费者的青睐[22]. 但是鲜切甘薯在生产过程中容易受到机械力的伤害,多酚氧化酶与酚类化合物原本的细胞区域被破坏,在氧气作用下甘薯表面生成棕色或黑色聚合物导致甘薯表面出现褐变,褐变不仅会影响甘薯外观,降低营养价值,还能导致甘薯变质腐烂和浪费,从而制约着甘薯产业的发展. 目前有研究显示PPO是导致果蔬褐变的主要物质[22-23],而mPPO是甘薯中主要的多酚氧化酶,当甘薯组织受到损伤后,其编码基因被诱导表达,mPPO活性逐渐增加,加速果蔬褐变腐烂,然而有关mPPO导致褐变的分子机制尚不明确,因此本研究主要利用同源建模和分子对接手段快速得到mPPO三维结构以及与底物结合的潜在位点,为筛选和设计抑制剂以及深入理解褐变机理提供了新的理论基础.
全文HTML
-
生物信息学数据库,如Uniprot(Universal Protein: https://www.uniprot.org/),PDB(Protein Date Bank: https://www.rcsb.org/);在线软件,如SWISS-MODELL,PISPRED,PROCHECK,ERRAT,SYBYL-X 2.0;本课题研究的甘薯膜结合态多酚氧化酶氨基酸序列来自Uniprot数据库(登录号: Q9MB14).
-
先从Uniprot数据库中下载甘薯膜结合态多酚氧化酶氨基酸序列,然后在蛋白质自动同源建模软件SWISS-MODELL中输入相应序列构建甘薯mPPO三维结构,通过建模反馈信息,获得了4个模板和1个目标模型(即mPPO三维结构),并将mPPO的三维结构保存为PDB格式以用于后续分子对接分析.
-
利用在线蛋白质三维结构评估软件PROCHECK和ERRAT对所获得的甘薯mPPO模型进行评估以及对氨基酸残基(aa)整体性进行分析.
-
从TCMSP(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform)数据库中(https://tcmspw.com/molecule.php?qn=415)下载底物邻苯二酚、绿原酸、没食子酸、焦性没食子酸、表儿茶素等酚类化合物3D结构,并保存为mol2格式,然后利用分子对接软件SYBYL-X 2.0以铜质体区域为对接位点,采用半柔性对接方式进行分子对接分析,探究mPPO与酚类化合物的潜在结合位点以及相互作用方式[24].
1.1. 材料
1.2. 方法
1.2.1. 同源建模
1.2.2. 模型评估
1.2.3. 分子对接分析
-
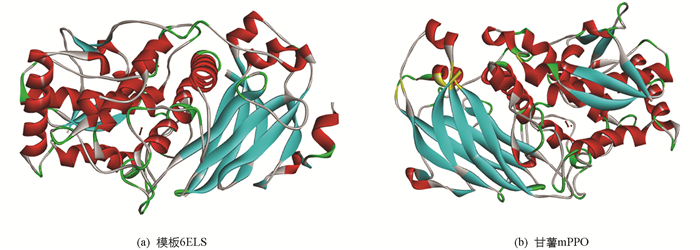
同源建模是利用具有同源性的蛋白质三维结构作为模板,对目标蛋白质进行三维结构预测. 由于蛋白中的三维结构比蛋白质一级结构更加保守,氨基酸的突变和替换通常发生在蛋白质表面回折区域,蛋白质主链结构、疏水核心结构受序列变异影响很小. 因此用同源建模预测蛋白质三维结构是比较可靠、快速的方法. 任何一对蛋白质,只要序列长度达到一定程度,序列相似性超过30%,则具有相似的三维结构[25]. 由于甘薯mPPO研究仍处于转录水平,蛋白质结构数据库中也无相应的结构信息. 利用SWISS-MODELL对甘薯mPPO同源建模,一共获得了4个多酚氧化酶三维结构模板,其在PDB数据库中的登录号分别为6ELS(Latent apple tyrosinase),4Z11(Latent aurone polyphenol oxidase),6R83(squid hemocyanin),4D87(Bacillus megaterium tyrosinase),氨基酸序列相似性分别为54.49%,44.02%,21.23%,23.57%. 由于序列相似性越高,获得的三维结构越可靠,因此选取了序列相似性最高的6ELS作为模板建模(图 1),使获得的模型最佳,其甘薯mPPO模型如图 2.
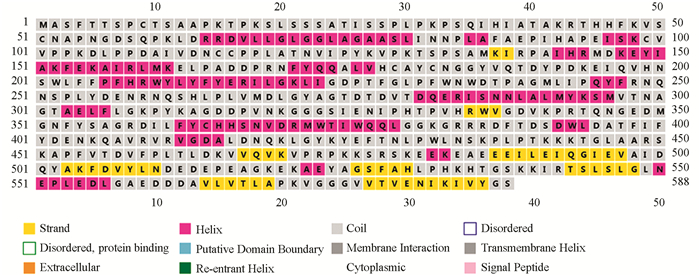
通过甘薯mPPO与模板6ELS序列比对以及利用PISPRED对mPPO二级结构预测发现,mPPO二级结构含有18个α-螺旋、9个β-转角、18个无规则卷曲(图 3),其1~50 aa和51~88 aa为2段跨膜信号序列,说明叶绿体内的mPPO会通过转移肽转移至细胞质内发挥作用. 结合图 2可以看出甘薯mPPO活性区域含有3个CuA和3个CuB,并被His178,His199,His208,His330,His334,His366包围. Cys99→Cys116,Cys115→Cys179,Cys182→Cys199组成了mPPO链间二硫键稳定着酶的结构.
-
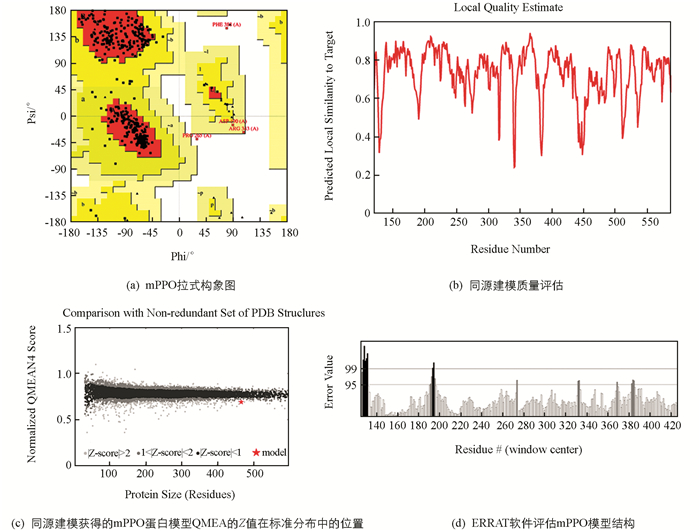
将SWISS-MODEL建模后序列相似性最高的mPPO模型通过PROHECK和ERRAT进行评估,图 4(a)显示了mPPO拉式构象图中有92%残基位于允许区[A,B,L],7.2%残基位于最大允许区域[a,b,l,p],0.5%残基位于扭转角禁止区域[~a,~b,~l,~p],一般认为允许区域超过90%,模型中蛋白质残基的二面角都在合理的区间,则符合立体化学能量规则,表明其模型的可靠性较高[26]. 图 4(b),图 4(c)显示mPPO的QMEAN为0.67(QMEAN值在0~1之间,数值越大,获得理想模型的可能性越大[27]),且Z值均大于2,反映出模型质量可靠. ERRAT对mPPO整体三维结构进行评估,有95.15%的残基在95%误差值以外,综上所述甘薯mPPO模型合格(图 4d),可以用于后续分析计算.
-
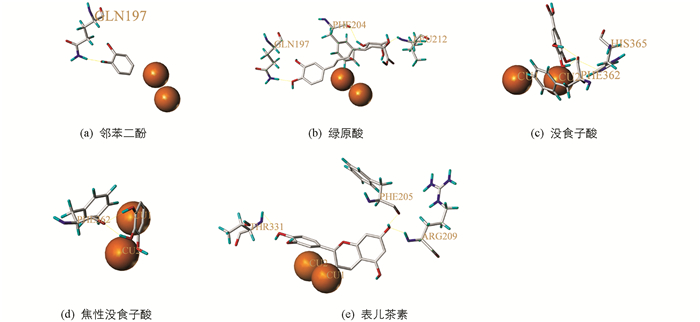
分子对接是在分子水平上通过化学计算研究分子的几何结构、分子间相互作用的方法,其理论基础来源于E.Fisher提出的“锁钥模型”,该模型描述了酶与底物专一性的结合,但存在一定局限性. Koshland提出了“诱导契合原理”,该理论认为受体和配体在相互结合时会发生结构变化[28]. 利用分子模拟软件SYBYLX-2.0分别将邻苯二酚、绿原酸、没食子酸、焦性没食子酸、表儿茶素与mPPO进行分子对接,在对接过程中蛋白受体和小分子配体的构象是可柔性可变化的,以满足空间形状和能量匹配. 结果发现在活性位点附近,Gln197,Leu212,Phe204,His365,Phe362,Phe205,Arg209,Thr331以氢键的方式与5种酚类化合物结合(表 1),说明这几个残基都是潜在结合位点(图 5).
2.1. 模型及其结构分析
2.2. 模型评估
2.3. 催化位点分析
-
蛋白质作为生命活动承担者,其具有的功能很大程度上与自身的空间结构有关,因此,对蛋白质空间结构的研究有助于了解其工作机理. 目前蛋白质数据库收集的蛋白质结构数量不断增加,但是蛋白质结构的测定仍然落后于基因测序[29]. X-射线晶体衍射和核磁共振技术是获取蛋白质结构信息的重要手段,但蛋白质晶体表达、提纯与结晶增加了测定的难度. 为了加快蛋白质结构测定速度,发展理论蛋白质结构测序方法显得尤为重要. 因此,利用蛋白质相关的数据库信息进行生物信息学分析不仅可以快速了解、认识目标蛋白质,还可以快速、高效地解析蛋白质的结构和功能,以研究蛋白质与配体的相互作用及其分子机制.
通过分析氨基酸序列发现,mPPO二级结构含有18个α-螺旋、9个β-转角、18个无规则卷曲,其中1~50 aa,51~88 aa为2段跨膜信号序列,这与茄子(81 aa),苹果(89 aa),土豆(86 aa),番茄(99 aa)mPPO跨膜转移肽不同[30],植物mPPO N-端转移肽差异可能与不同物种mPPO转运方式有关. 铜质体区域是甘薯mPPO活性部位,受His178,His199,His208,His330,His334,His366包围,而在单亚基甘薯多酚氧化酶中,只存在单个铜质体,并被His240,His244,His274包围,葡萄PPO中活性区域受His211,His220,His342,His346,His375包围[31],这表明PPO活性区域差异与所编码的基因以及所在区域的执行功能有关.
分子对接结果显示,甘薯mPPO中Gln197,Leu212,Phe204,His365,Phe362,Phe205,Arg209,Thr331等残基与邻苯二酚、绿原酸、没食子酸、焦性没食子酸、表儿茶素相互作用,表明甘薯mPPO不仅催化区域广,而且催化底物种类多,而甘薯组织受到机械伤害时,能与各种酚类物质反应,验证了多酚氧化酶是导致果蔬褐变的主要氧化酶. 氢键驱动mPPO和底物结合,正是由于他们之间的这种分子相互作用,使得甘薯mPPO与底物结合的亲和力高,促进了甘薯mPPO催化效率. 因此,可以通过结合位点设计抑制剂屏蔽掉相关氨基酸残基上的官能团,削弱与酶的结合能力,该实验结果还可以通过基因敲除或者RNA干扰技术培育无褐变甘薯品种,扩大甘薯物种丰富度,降低因褐变造成的经济损失.
综上所述,本实验挖掘甘薯mPPO相关数据掌握了其结构特征以及潜在催化靶点,为进一步揭示甘薯褐变分子机制和筛选高效无毒害抑制剂提供了新的思路.




 下载:
下载: