-
桑树萎缩病Mulberry dwarf disease是桑树中的重要病害之一,在我国各大养殖蚕区均有发生,且发病率较高,对蚕桑生产造成严重的经济损失,并且对其防治也越发困难.近年来,随着传统蚕桑地区产业结构的调整,我国蚕桑生产基地也发生了转移,桑树萎缩病在新的种植区也再度爆发.同时,在其他林木果树(如泡桐、枣树、木豆等)中也相继有新的植原体病害报道,这些病害也可能与桑树萎缩病病原有关[1].
已经证实引起桑树萎缩病的病原有病毒和植原体.病毒在桑树上主要引发花叶型萎缩,而植原体则主要引发萎缩型和黄化型萎缩[2].桑黄化型萎缩病是桑树上的主要病害类型,属国内植物中重要检疫性病害之一,也是国际上首先被确定为由植原体引起的病害之一.因植原体在全世界广泛存在,危害着数百种植物,又因其发生后对作物产量影响严重,受到国内外学者的高度重视.迄今为止,世界各地已统计有700多种植物自然感染植原体病害,而我国早在1976年就将桑树萎缩病确定为植原体病害,同时报道了70多种植物植原体病害.根据16S rDNA序列的相似性分析,桑树植原体归为翠菊黄花组,即16S r Ⅰ组.其病害症状表现为植株矮化、丛枝、叶片变黄或变红及花变叶等,而病毒也可以引起叶片黄化、节间缩短、叶缘卷曲、花叶等类似的症状.因此,单从症状上区分桑树萎缩是由病毒还是植原体引起的仍是一个难题[3].
目前,国内一些地区使用分子生物学技术对当地桑萎缩病的病原进行分析鉴定,从而初步解决了之前研究上的困难.早在1998年,邱并生等[4]首先对江苏镇江的桑黄化型和萎缩型萎缩病植原体的16S rDNA进行分析比较,推断这两种植原体属于16S r Ⅰ组.之后,夏志松等[5]和刘清神等[6]更多学者先后报道了镇江和广州桑树萎缩病植原体16S rDNA的序列.目前重庆地区未见桑树萎缩病植原体病害的相关报道,为了研究鉴定重庆桑树萎缩病的植原体种类,本实验采用nested-PCR技术对重庆北碚发生的萎缩病进行分子检测.对检测到的植原体16S rDNA进行序列测定和分析,通过序列同源性分析确定了其分类地位,为进一步研究、诊断、控制桑树萎缩病提供了一定的理论依据.
全文HTML
-
表现萎缩症状的病叶样品和健康桑叶采自重庆北碚区. DNA凝胶回收试剂盒购自天根科技有限公司,载体pGEM-T Easy Vector购自Promaga公司,感受态细胞Trans1-T1 Phage Resistant购自北京全式金生物技术有限公司,其他生物学试剂均购自TaKaRa公司.
-
采用改良的CTAB法分别提取病叶和健康桑叶的总DNA,-20 ℃保存.
-
PCR引物根据植原体16S-23S rDNA区段序列按文献[4]设计,采用引物对R16F2/R16R1及R16F2n/R16R2(表 1),引物合成由华大基因公司完成.
-
以桑树叶脉组织总DNA为模板进行PCR扩增,PCR反应体系为25 μL,含有10×Reaction buffer 2.5μL,10 mmol/L dNTPs 0.5 μL,rTaq DNA聚合酶0.3 μL (1U),上、下游引物各0.5 μL,模板DNA 1.0 μL,剩余以灭菌ddH2O补足.先用引物对R16F2/R16R1进行第一轮PCR,扩增条件为:95 ℃预变性3 min,95 ℃变性30 s,58 ℃退火50 s,72 ℃延伸110 s,进行30个循环,最后72 ℃延伸时间为10 min.用上一轮扩增产物为模板,以R16F2n/R16R2为引物对进行新一轮PCR,将退火温度改为53 ℃,其余条件与第一轮相同.用1%琼脂糖凝胶电泳检测PCR产物,在110 V下电泳25 min,经Goldview染色后观察电泳结果并拍照.
-
采用DNA纯化试剂盒纯化回收凝胶电泳后的PCR目的片段,连接回收的片段至pGEM-T Easy Vector,4 ℃ 16 h.热激法将连接产物转入大肠杆菌感受态细胞Trans1-T1 Phage Resistant,经筛选培养基筛选后,挑白色菌落进行PCR检测,随机挑选3个阳性克隆送到华大基因科技股份有限公司测序.
-
测序所得序列在GenBank中BLAST比对,根据序列的同一性判断所获序列是否为目的序列.再运用DNAStar中的MegAlign软件,以16S rDNA序列为基础,对比分析北碚桑树植原体与已报道的植原体若干代表株系的亲缘关系[7-8],并用MAGA 5构建系统进化树[9].
1.1. 材料
1.2. 样品总DNA提取
1.3. 引物的设计与合成
1.4. 目的基因的PCR扩增
1.5. PCR产物回收、克隆及测序分析
1.6. 目的基因的序列分析
-
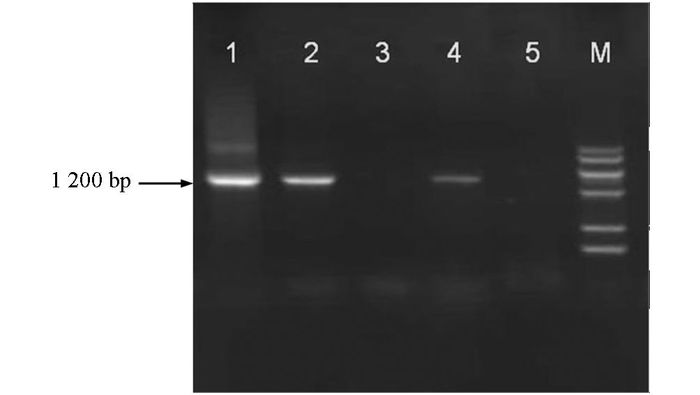
以样品提取的DNA为模板,利用植原体16S rDNA通用引物进行PCR扩增.扩增产物电泳结果显示,有3个样品(编号分别为C,I,S)扩增出长度约1.2 kb的片段,与预期目标片段大小一致[9].而从健康桑树叶片和双蒸水中均未扩增出特异条带(图 1).
-
样品C,I,S的测序结果表明,其16S rDNA片段的核苷酸长度均为1 237 bp(图 2),上传至GenBank,分别获得登录号KF289966,KF289967,KF289968.将这3条序列与已登录的其他植原体16S rDNA序列进行同源性分析,结果如表 2所示.这3条序列与16S r Ⅰ组同源性最高,均在98.3%以上,最高达99.8%,与其他各组的同源性在90%以下. 3个样品序列均与植原体16S r Ⅰ的B亚组同源性最高,分别为C:99.2%,I:99.8%,S:99.6%.利用网络在线分析软件iPhyClassifier (http://plantpathology. ba. ars. usda. gov/cgi-bin/resource/iphyclassifier. cgi)中模拟RFLP分析表明,C与16S r Ⅰ-B亚组典型成员洋葱黄化植原体(Onion yellows phytoplasma OY-M,NC_005303) 的RFLP图谱一致性为100%,属于16S r Ⅰ-B亚组.而Ⅰ和S的模拟RFLP图谱不同于与16S r Ⅰ组的任何亚组,相似性最高的是洋葱黄化植原体的RFLP图谱,一致性为97.0%.
-
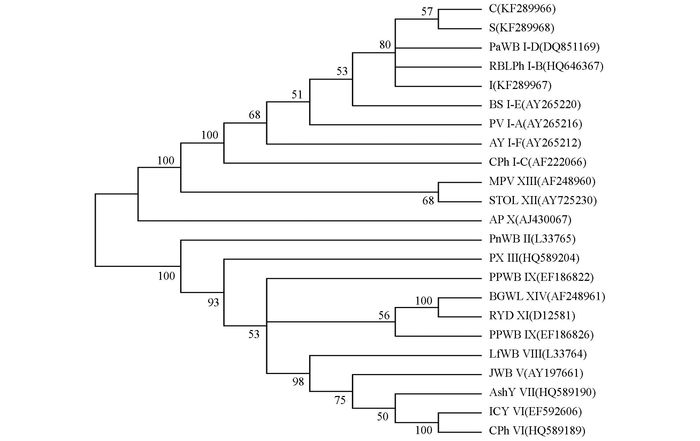
利用MEGA5,将C,I,S与已报道的16S r植原体的若干代表株系一起构建系统进化树(图 3).从图 3中可以看出,C,I,S的16S rDNA序列划分在16S r Ⅰ组,与上面的同源性比较结果一致.
2.1. 桑树叶片中的植原体检测
2.2. 16S rDNA序列分析
2.2.1. 对16S rDNA基因序列分析
2.2.2. 16S rDNA基因同源性比较分析
-
桑树萎缩病有黄化型、萎缩型和花叶型3种类型,前二者的病原为植原体,后者的病原为病毒[10].三者在田间症状比较相似,因此单从症状上很难区分具体病害种类.桑树萎缩病在我国江苏、安徽、山西、山东、广东等省蚕区都发生危害.发病初期桑叶变小变薄,叶缘稍向背面卷曲,叶逐渐黄化;发病后期病桑枝短叶小,2~3年后桑树死亡[11-13].由于植原体在植物体内的含量较少,并且难以人工培养,使得传统的生物学方法在其分类和鉴定中不能很好地发挥作用.但是近些年由于分子生物学的发展,使得植原体的分类和鉴定也有了较大的进展.目前,植原体分类已经以16S rDNA基因的限制性片段长度多态性分析(RFLP)和核糖体蛋白基因(rp)序列分析为基本框架,将植原体分为14个组(候选种)和41个亚组.本研究采用nested-PCR方法,是由于该技术具有特异性强、准确度和灵敏度高等优点,能快速准确地检测到寄主组织中含量极低的病原.在所采集的表现萎缩症状的桑叶样品中,仅有3份样品检出为阳性,说明其他病叶可能是由于病毒感染或者是其他因素所引起的,还有待进一步验证.本研究3份样品中扩增出的16S rDNA序列之间的相似性在99.2%~99.6%之间,并且都属于翠菊黄化16S r Ⅰ组,其中C进一步归属于16S r Ⅰ-B亚组,与国内广州[4]和山东[10]报道的桑树萎缩病植原体一致,而I和S与16S r Ⅰ-B亚组亲缘关系最近,但由于模拟RFLP图谱不完全一致,还不能确定其亚组归属.本研究表明,重庆北碚桑树中的植原体属于16S r Ⅰ组,因16S rDNA基因存在多样性,这对于植原体分类的深入研究具有一定的参考价值.




 下载:
下载: