-
开放科学(资源服务)标识码(OSID):

-
钙是人体不可缺少的营养元素,缺钙会导致骨质疏松、营养不良,严重影响人体正常发育和骨骼发展. 正常情况下人体每日所需钙量为800 mg,但儿童、老人群体每日需要的钙量为1 200 mg. 随着人们生活水平的提高,对高品质、功能型蔬菜的需求也不断提升. 钙作为蔬菜正常生长发育过程中不可或缺的营养元素,参与蔬菜种子萌发、生长分化、形态建成和开花结果等过程[1]. 同时,钙离子在细胞信号转导系统中作为第二信使参与蔬菜细胞内信号的传递,从而调控蔬菜的各种生理生化反应和生长发育过程[2]. 0.5~4.0 mmol/L钙水平可显著提高白菜叶片的净光合速率、气孔导度以及蒸腾速率,且对钙敏感型品种菊春的影响显著大于迟钝型品种德高春[3]. 喷施0.2% 的外源氯化钙后,番茄的单果质量、单株结果数和单株产量均显著增加[4]. 钙肥的施用还可以改良土壤性能,调节土壤酸碱性,消除某些离子的毒害作用[5]. 在营养液中添加10 mmol/L CaCl2,可缓解铜离子胁迫,明显促进花椰菜地上部和根系的生长,使地上部和根系的鲜质量、干质量增加[6]. 但也有研究显示,高钙水平会抑制蔬菜对钾、镁的吸收,也会降低铁、锰、硼、锌等元素的有效性,使蔬菜体内养分失衡,甚至会影响蔬菜的光合作用,从而导致其正常的生长发育受阻[7-8]. 另外,细胞中过多的游离钙离子会和磷酸根离子形成沉淀,使钙离子信号传递受阻,磷代谢等有关过程也会受到干扰,从而使细胞的正常功能受损,甚至死亡,影响蔬菜的生长发育. 我国土壤溶液中的钙浓度约为10-2 mol/L,土壤表土层平均含钙量可达1.37%,正常情况下能够满足大多数作物的需要[9]. 但近期有研究表明,南方因降雨充沛,土壤含钙量较低,而北方土壤富钙,在干旱条件下,土壤溶液钙浓度会升高,从而抑制根系对钙的吸收,导致部分作物出现生理性缺钙,钙需求量较大的果树、蔬菜缺钙现象更为普遍[10]. 同时,近年来由于追求高产、土壤酸化和化肥施用等因素的作用,土壤钙供应不足[9],加之设施栽培的大量涌现,更容易导致棚室土壤缺钙[11].
蔬菜吸收钙的主要部位是根尖和侧根处[12]. 蔬菜根系对钙离子(Ca2+)的吸收过程一般包括:①土壤中的Ca2+通过质流扩散和根系截获的方式转移到蔬菜根系的表面,根系通过扩散或细胞间隙的交换使Ca2+进入根系细胞,之后Ca2+通过质外体途径进行短距离横向运输,到达木质部[13];②部分Ca2+还可以通过离子通道进入内皮层细胞,转入共质体,从而进入木质部薄壁细胞组织[14-15]. 蔬菜中的Ca2+主要在木质部进行长距离运输,在韧皮部的运输十分有限,蒸腾作用是其运输的主要动力[16]. 另外,Ca2+的运输分配还受钙传递分子途径、木质部水分流量和钙信号与细胞壁的相互作用等影响[17]. Ca2+转运系统在蔬菜从外界环境中吸收钙以及运输和分配钙的过程中发挥着重要作用[18],该转运系统主要包括2类:胞质Ca2+外流系统(Ca2+/H+反向转运蛋白和Ca2+-ATPase)和Ca2+进入胞质的内流系统(Ca2+通道)[19]. 其中,Ca2+-ATPase又称钙泵(calcium pump),Ca2+-ATPase属于P-型ATP酶,根据其蛋白质氨基酸序列和生化特征的差异可以分为2个家族:内质网(ER)型钙泵(ER-type calcium ATPase,ECA)和自抑制的质膜(PM)型钙泵(autoinhibited calcium ATPase,ACA)[20]. 其中,ECA分布在质膜、内质网和液泡膜上,只能水解底物ATP,对其有专一性,被CPA(cyclopiazonic acid)专性抑制,不受钙调素(calmodulin,CaM)蛋白激活调控[21-22]. 蔬菜细胞内感受胞质钙离子浓度变化的原件被称为Ca2+感受器(calcium sensor,CAS).
CAS是一种跨膜蛋白,可以传递钙信号,进而调控基因的表达,达到维持蔬菜胞质钙离子浓度稳态的目的[23]. CAS感受到胞外钙离子后,产生肌醇三磷酸(inositol triphosphate,IP3)和环腺苷酸二磷酸核糖(cyclic adenylate diphosphate ribose,cADPR)等第二信使,从而引起胞内钙离子浓度的变化[24]. Han等[25]通过功能基因筛选法(functional screening approach)首次在拟南芥中成功克隆了胞外钙感受器基因CAS,这为进一步研究其在蔬菜钙富集中的作用奠定了坚实的基础. 植物ECA、CAS基因可以感受胞外Ca2+水平,提高胞内Ca2+的浓度,因此探究其在不同Ca2+浓度蔬菜中的表达情况将为提高蔬菜中的钙质量分数提供分子基础. 本试验基于课题组前期研究,以我国白菜栽培较为广泛的两个品种‘黑叶五月慢’和‘上海六月慢’为试验材料,采用盆栽试验研究了钙诱导下两个白菜品种的转录代谢信息差异,以及钙富集关键酶基因表达水平的影响,探讨了钙富集关键酶基因表达与白菜钙质量分数之间的相关性,以期为高钙白菜品种选育提供技术支撑.
HTML
-
供试白菜(Brassia chinensis L.),品种为‘黑叶五月慢’和‘上海六月慢’. 栽培基质以草炭土、珍珠岩、蛭石按体积比3∶1∶1混合,其基本理化性质为:pH值为6.50,有机质为221.8 g/kg,全氮为3.13 g/kg,碱解氮为0.57 g/kg,有效磷为17.97 mg/kg,速效钾为150.32 mg/kg,有效钙为0.32 g/kg.
-
盆栽试验于2021年3月15日至2021年4月30日在西南大学1号玻璃温室内进行. 蔬菜种植在无孔黑色塑料桶中(上口直径25 cm,底部直径20 cm,高度29 cm),每盆装入栽培基质9.5 L. 钙肥品种选择CaSO4·2H2O,用作基肥与氮、磷、钾肥一起以土施的方式施入,试验设置5个浓度(0,0.2,0.4,0.6和0.8 g/kg)与两个白菜品种两两组合,随机排列,每盆种植4株,每个处理设置3次重复. 白菜氮肥总施用量为180 mg/kg,磷肥100 mg/kg、钾肥150 mg/kg,氮肥、磷肥和钾肥分别以尿素、磷酸二氢铵和硫酸钾为肥源,其中,磷、钾作为基肥施入,氮肥用量的70%作为基肥施入,同时施入钙肥,与土壤混匀,平衡2周,剩余30%的氮肥作追肥在移栽后的第20天施入. 土壤平衡结束后,选取长势一致且健壮的4叶1心的白菜幼苗进行移栽,培养期间用纯水保持基质含水量为饱和含水量的70%~80%. 白菜生长45天后收获.
-
pH采用土水比1∶1的方法测定;有机质、全氮、碱解氮、有效磷、速效钾等基本理化指标用常规方法测定[26]. 植株收获后先用自来水冲洗干净,然后用去离子水清洗3次,然后分离根、茎、叶和果实,在105 ℃下杀青15 min,60 ℃下烘干称重,用破壁机打磨干样,全钙质量分数采用HNO3-HClO4消化,原子吸收分光光度法进行测定[26]. 参照刘双等[27]和王春晓等[28]的计算方法计算植株钙元素积累量,计算公式如下:
-
选取成熟期白菜第5~6位叶片用于总RNA提取、mRNA纯化、cDNA文库构建及高通量测序(深圳华大基因股份有限公司). 基本过程为:用mRNA富集法对总RNA进行处理,用打断buffer把获得的RNA片段化,结合cDNA二链形成双链DNA,双链DNA处理过后进行PCR扩增、热变性成单链直至得到单链环状DNA文库,将检测合格的文库进行Illumina测序.
-
原始测序数据首先通过SOAPnuke 1.4.0软件去除接头及低质量的序列,之后利用Hisat 2.1.0将获得的clean reads比对到大白菜参考基因组,使用Bowtie 2将clean reads比对到基因组序列上,然后使用RSEM计算各个样品的基因表达水平. 通过DESeq 2软件进行样品组间差异表达分析,将满足阈值|log2FC|≥1且FDR<0.05的基因定义为差异表达基因(DEG),并对差异表达基因进行GO(Gene Ontology)功能注释及KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析[29].
-
本试验白菜材料的总RNA采用北京全式金有限公司TransZol Up Plus RNA Kit抽提试剂盒提取,提取出的一部分RNA用于RNA的质量检测,剩余的RNA保存在-80 ℃冰箱中,等待进一步的纯化和反转录.
-
使用北京全式金生物技术有限公司反转录试剂盒(TransCript One-Step gDNA Removal and Cdna Synthesis SuperMix)进行RNA反转录. 首先去除残存基因组DNA,再按照试剂盒说明进行RNA反转录反应. 反转录所合成的cDNA置于-20 ℃条件下保存.
-
用ddH2O将反转录产物cDNA稀释3倍,荧光定量PCR采用Power Up TM SYBRTM Green Master Mix(AppliedBiosysrems,Vilnius,Lithuania)试剂盒配制反应体系. 使用Applied Biosystems 7500 Real Time PCR system进行定量PCR反应. PCR反应程序为:95 ℃预变性10 min,95 ℃变性30 s,60 ℃退火30 s,40个循环;60 ℃上升至95 ℃检测产物溶解曲线,所有试验重复3次. 用2-ΔΔCT的方法计算目标基因的相对表达量,CT值表示荧光信号达到设定阈值所经历的反应循环数[30]. 其中PCR反应体系为2 μL cDNA,7.2 μL ddH2O,0.4 μL Primer-Forward(10 μM),0.4 μL Primer-Reverse(10 μM),10 μL 2×SYBR Green Mix. 引物设计如表 1所示.
-
使用Microsoft Excel 2019进行数据的统计处理和制图,采用IBM SPSS Statistics 25.0进行相关性分析(Pearson相关系数法),Fisher least significant difference(LSD)检测法进行不同处理均值的差异显著性比较(p<0.05).
1.1. 试验材料
1.2. 试验方法
1.3. 测定指标与方法
1.3.1. 基质基本理化性质和植物钙质量分数分析
1.3.2. 转录组测序
1.3.2.1. 总RNA提取、cDNA文库构建及Illumina测序
1.3.2.2. RNA-seq分析
1.3.3. 钙富集关键酶基因表达研究
1.3.3.1. 总RNA提取与质量检测
1.3.3.2. RNA的纯化与反转录
1.3.3.3. 引物及目标基因的qRT-PCR分析
1.4. 数据处理与统计分析
-
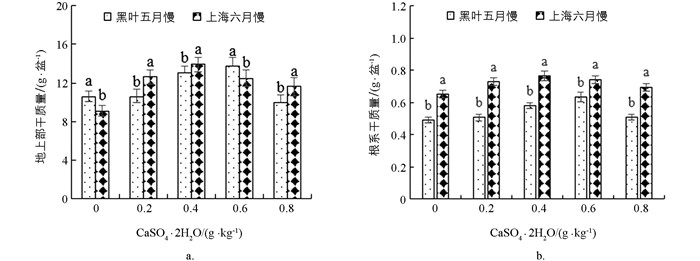
不同施钙水平(0,0.2,0.4,0.6和0.8 g/kg CaSO4·2H2O)下‘黑叶五月慢’和‘上海六月慢’的地上部生物量和根生物量如图 1所示. ‘黑叶五月慢’的地上部随着钙肥水平的提高呈先升高再降低的趋势,根生物量的变化趋势与之相似,先升高后降低,与对照组相比各处理的地上部和根生物量分别增加了23.22%~29.79%和3.35%~28.96%,‘黑叶五月慢’的地上部和根生物量均在0.6 g/kg CaSO4·2H2O处理下达到最大值. ‘上海六月慢’的地上部和根生物量的变化趋势相同,均表现为先升高后降低,各处理的地上部和根生物量较对照分别增加了27.62%~53%和6.91%~17.74%,在0.4 g/kg CaSO4·2H2O处理下该品种的地上部和根生物量达到最大值,分别为116.11和5.11 g/盆. 与对照相比,‘黑叶五月慢’的地上部和根生物量均在0.4和0.6 g/kg CaSO4·2H2O处理下存在显著差异;‘上海六月慢’各施钙处理下的地上部生物量较对照均表现出显著差异,而根生物量仅在0.2,0.4和0.6 g/kg CaSO4·2H2O处理下表现出显著差异.
-
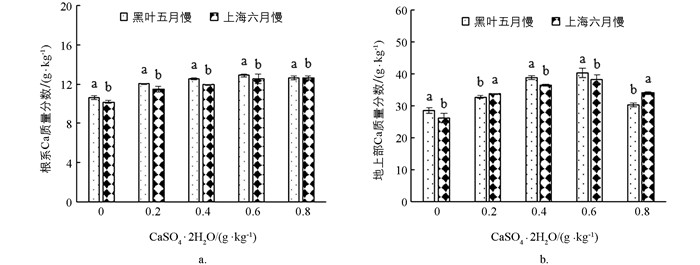
如图 2所示,‘黑叶五月慢’和‘上海六月慢’的地上部和根系钙质量分数均随着施钙水平的增加呈先增加后降低的趋势,在0.6 g/kg CaSO4·2H2O处理下达到最大值. ‘黑叶五月慢’地上部和根系钙质量分数较对照分别增加了14.0%~21.6%和12.7%~24.4%;‘上海六月慢’地上部和根系钙质量分数分别较对照增加了6.6%~41.3%和29.1%~46.9%. 总体来讲,‘黑叶五月慢’的地上部和根系钙质量分数均高于‘上海六月慢’.
-
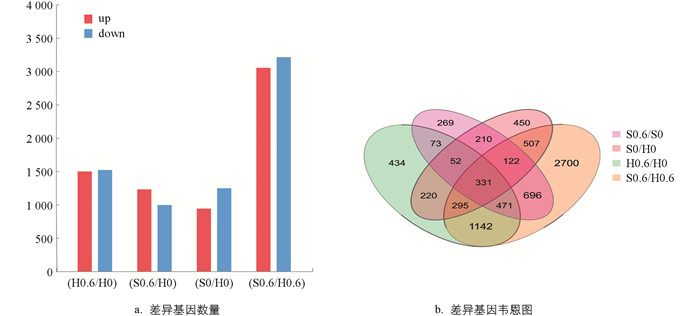
本试验以|log2FC|≥0,Q值≤0.05为标准来筛选差异表达基因,并对差异表达基因进行统计分析,如图 3所示,‘黑叶五月慢’施钙处理与对照组相比共筛选到3 018个差异表达基因,其中1 498个上调表达,1 520个下调表达;‘上海六月慢’施钙处理与对照组相比共筛选到2 224个差异表达基因,其中1 229个上调表达,995个下调表达;‘黑叶五月慢’对照组与‘上海六月慢’对照组相比共筛选到2 187个差异表达基因,其中941个上调表达,1 246个下调表达;‘黑叶五月慢’施钙处理与‘上海六月慢’施钙处理相比共筛选到6 264个差异表达基因,其中3 052个上调表达,3 212个下调表达. 对这些差异表达基因作韦恩图分析,结果表明:‘黑叶五月慢’施钙处理及对照组与‘上海六月慢’施钙处理及对照组之间存在927个差异表达基因;‘黑叶五月慢’和‘上海六月慢’的对照组与‘黑叶五月慢’和‘上海六月慢’的施钙处理之间存在1 255个差异表达基因.
-
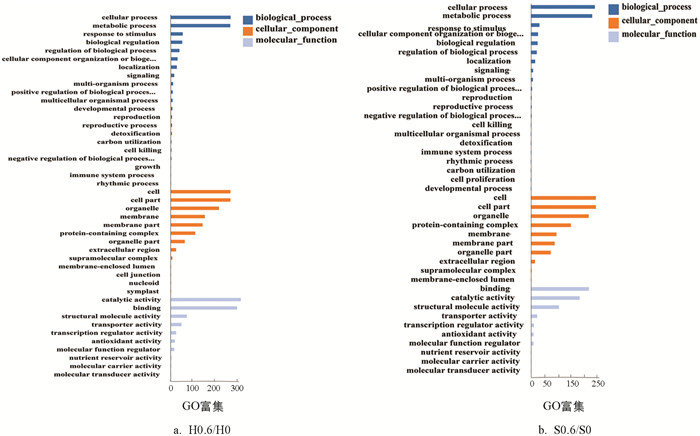
如图 4所示,‘黑叶五月慢’和‘上海六月慢’的差异表达基因主要富集在生物学过程(biological process)、细胞组分(cellular component)和分子功能(molecular function). ‘黑叶五月慢’施钙处理与对照组在生物过程类别中包含基因数较多的条目依次是:细胞过程(cellular process)322个、代谢过程(meta-bolic process)320个、应激反应(response to stimulus)64个和生物调控(biological regulation)61个;在细胞组分类别中富集较多的条目依次是:细胞(cell)321个、细胞部分(cell part)321个、细胞器(organelle)259个、膜(membrane)183个和膜部分(membrane part)171个;在分子功能类别中富集较多的条目依次是:催化活性(catalytic activity)377个、联结(binding)357个、结构分子活动(structural molecule activity)86个和转运活动(transporter activity)57个. ‘上海六月慢’施钙处理与对照组在生物过程类别中包含基因数较多的条目依次是:细胞过程312个、代谢过程299个、应激反应42个和细胞组分或生物合成(cellular component organization or biogenesis)35个;在细胞组分类别中富集较多的条目依次是:细胞317个、细胞部分317个、细胞器282个、蛋白质复合物(protein-containing complex)195个和膜(membrane)125个;在分子功能类别中富集较多的条目依次是:联结283个、催化活性238个、结构分子活动137个和转运活动31个.
-
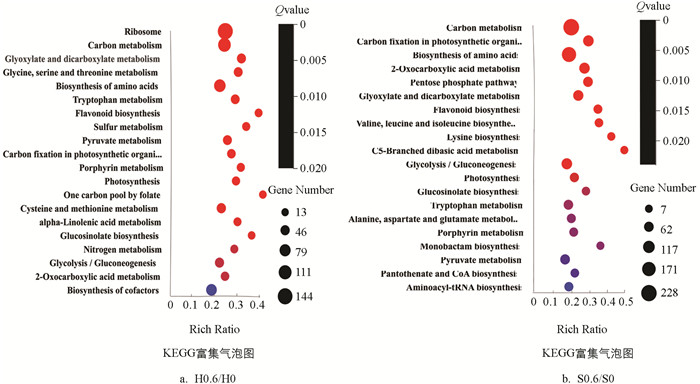
由图 5可知,‘黑叶五月慢’和‘上海六月慢’施钙处理较对照组在转运和分解代谢(transport and catabolism)通路中的差异表达基因数目分别为67和47个;在环境信息处理类别下,两个品种施钙处理较对照组在信号转导(signal transduction)通路中的差异表达基因数目分别为68和50个;在新陈代谢类别下,两个品种施钙处理较对照组在氨基酸代谢(amino acid metabolism)通路中的差异表达基因数目分别为163和130个,‘黑叶五月慢’施钙处理和对照组的差异表达基因主要富集在碳代谢(carbon metabolism)、氨基酸的生物合成(biosynthesis of amino acids)、甘氨酸、丝氨酸和苏氨酸代谢(glycine,serine and threonine metabolism)、丙酮酸代谢(pyruvate metabolism)、氮代谢(nitrogen metabolism)、α-亚麻酸代谢(alpha-Linolenic acid metabolism)等代谢通路. ‘上海六月慢’施钙处理和对照组的差异表达基因主要富集在氨基酸的生物合成(biosynthesis of amino acids)、赖氨酸生物合成(lysine biosynthesis)、色氨酸代谢(tryptophan metabolism)、半胱氨酸和蛋氨酸代谢(cysteine and methionine metabolism)、戊糖磷酸途径(pentose phosphate pathway)、缬氨酸、亮氨酸和异亮氨酸生物合成(valine,leucine and isoleucine biosynthesis)、生物素代谢(biotin metabolism)代谢通路.
-
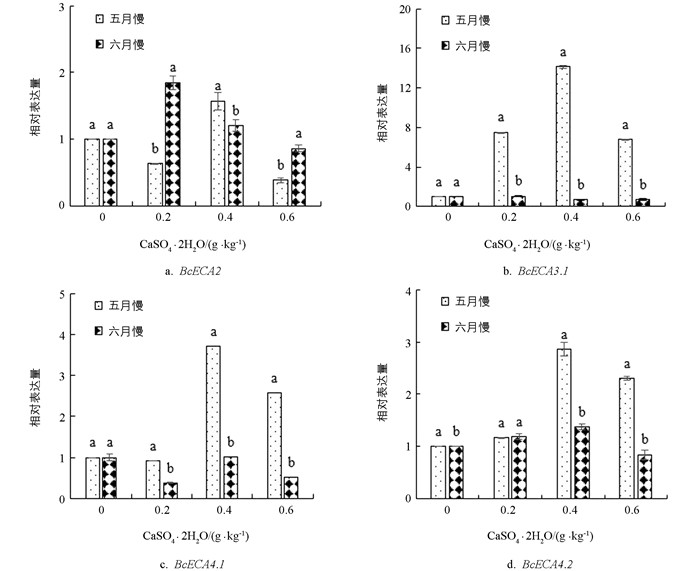
由图 6可知,‘黑叶五月慢’ BcECA2基因仅在0.4 g/kg钙水平处理时上调表达,表达量是对照的1.08倍;‘上海六月慢’ BcECA2基因表达量随着施钙量的增加先上调后下调,在0.2 g/kg和0.4 g/kg钙水平处理下分别是对照的1.91和1.14倍. 与对照相比,施钙处理后‘黑叶五月慢’BcECA3.1基因均上调表达,表达量随施钙水平的提高先上调后下调;‘上海六月慢’ BcECA3.1基因表达量在0.4 g/kg和0.6 g/kg钙水平处理下均表现为下调. 两个品种的BcECA4.1基因表达量变化趋势一致,均在0.4 g/kg钙水平处理下达到最大值. 与对照相比,施钙处理后‘黑叶五月慢’ BcECA4.2基因表达量均上调,在0.4 g/kg和0.6 g/kg钙水平处理下较对照提高了1.93和1.35倍;‘上海六月慢’ BcECA4.2基因表达量随着施钙量的增加先上调后下调,在0.4 g/kg钙水平处理下达到最大.
-
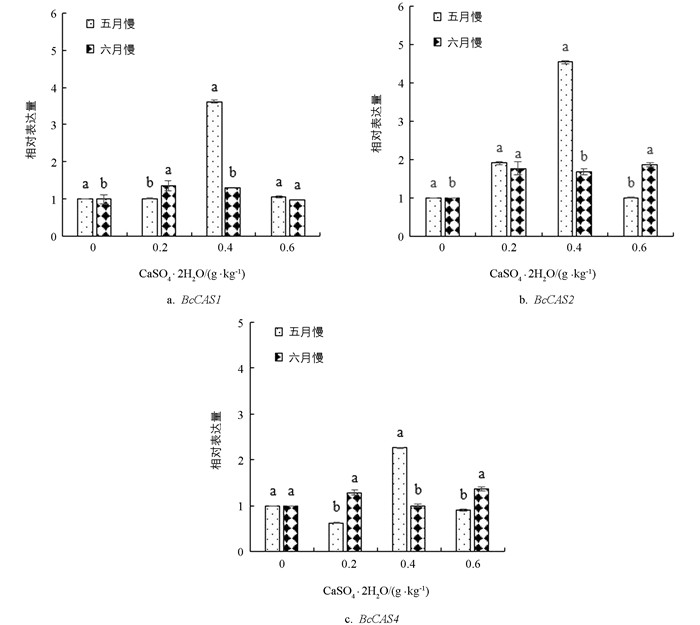
由图 7可知,‘黑叶五月慢’和‘上海六月慢’的BcCAS1基因表达量均随着施钙量的增加先上调后下调,‘黑叶五月慢’在0.4 g/kg钙水平处理下BcCAS1基因表达量达到最大值,较对照提高了2.76倍;‘上海六月慢’在0.2 g/kg钙水平处理下达到最大值. ‘黑叶五月慢’的BcCAS2基因表达量随施钙水平的提高先上调后下调,在0.4 g/kg钙水平处理下达到最大值;与对照相比,施钙处理后‘上海六月慢’的CAS2基因表达量整体上调,是对照的1.64~2.09倍. ‘黑叶五月慢’的BcCAS4基因表达量在0.4 g/kg钙水平处理下较对照提高了1.32倍;与对照相比,‘上海六月慢’的BcCAS4基因表达量整体上调,在0.6 g/kg钙水平处理下达到最大值.
-
如表 3所示,Pearson相关性分析结果表明,白菜钙质量分数与BcECA2,BcECA3.1,BcECA4.1和BcECA4.2相对表达量均呈正相关关系,其相关系数分别为0.737,0.204,0.286和0.524,且与BcECA2的相关性达到显著水平;钙质量分数与BcCAS1,BcCAS2和BcCAS4相对表达量也均呈正相关关系,其相关系数分别为0.661,0.489和0.184,但其相关性均未达到显著水平.
2.1. 供钙水平对白菜生物量的影响
2.2. 钙质量分数
2.3. 差异表达基因分析
2.4. 差异表达基因GO分析
2.5. 差异表达基因KEGG通路分析
2.6. 供钙水平对白菜钙富集关键基因表达的影响
2.6.1. BcECA 家族基因
2.6.2. BcCAS家族基因
2.7. BcECA和BcCAS家族基因表达与白菜钙质量分数相关性分析
-
土壤缺钙或白菜对钙的吸收与利用受阻,会严重影响白菜正常生长和产量形成[31]. 本试验中,施钙显著促进了白菜生长,提高了地上部和根系的生物量. 随着施钙水平的提高,‘黑叶五月慢’和‘上海六月慢’地上部和根系的钙质量分数及钙积累量均呈先上升后下降趋势,生物量和钙质量分数基本都在0.4或0.6 g/kg CaSO4·2H2O处理时达到最大值. 说明适宜浓度或用量的外源钙能够提高白菜的产量和钙质量分数,但浓度或用量过大反而对白菜生长和钙吸收不利[11].
转录组分析发现‘黑叶五月慢’和‘上海六月慢’中分别有3018和2224个差异表达基因,说明钙对两个白菜品种的基因表达影响不同. 在GO分析中,两个白菜品种对照和施钙处理的差异表达基因主要富集在细胞组分这一类别中,因为植物中绝大部分钙是细胞壁的果胶质结构成分,与果胶酸形成果胶酸钙被固定于相邻2个细胞壁之间. 通过GO功能分析发现,差异表达基因主要富集在催化活性、联结、结构分子活动和转运活动,表明钙在白菜生长发育的多个代谢途径中均发挥着重要作用. 该结果与张圣美等[32]报道一致. 对两个白菜品种的对照和施钙处理进行KEGG分析发现,差异表达基因富集在了转运和分解代谢通路中,表明外源施用钙肥后,为了调节植物体内外钙离子的平衡,相关转运基因开始表达. 钙离子可与含EF手性单元结构的钙离子感受蛋白结合,调节下游靶蛋白活性,起到重要的信使作用[33]. 本研究结果显示,差异表达基因富集在信号转导通路中,这说明施钙后白菜能够迅速响应外界钙离子浓度的变化. ‘黑叶五月慢’和‘上海六月慢’的对照和施钙处理的差异表达基因富集在氨基酸的生物合成、氨基酸代谢、甘氨酸、丝氨酸和苏氨酸代谢、氮代谢和α-亚麻酸代谢等通路中. 檀龙颜等[34]指出,钙胁迫下越南槐萌发种子中谷氨酰胺合成酶基因表达上调,证明了越南槐种子通过调控氨基酸代谢适应高钙环境. 而丝氨酸可以作为胁迫条件下次生代谢物合成的前体[35]. 这与本试验的研究结果一致.
环境缺钙和钙离子(Ca2+)运输、利用效率低是造成植物缺钙的2个主要原因[31]. 王照[36]研究指出,ECA基因家族参与调控植物对Ca2+的吸收转运过程,同时,RrECA2在刺梨根系中的表达与钙吸收速率呈正相关,RrECA1在叶片中的表达与钙吸收速率呈正相关,对刺梨吸收Ca2+具有重要意义. 在本研究中,施用钙肥后,两个白菜品种的BcECA家族基因上调表达,BcECA2表达量在两个品种中均显著上调,在0.4 g/kg的钙处理下,BcECA3.1,BcECA4.1和BcECA4.2表达量在‘黑叶五月慢’品种中显著上调. CAS在拟南芥基因组中是一个单拷贝基因,它编码了一个由387个氨基酸组成的蛋白质,分子量为41 268 Da. 实验表明BcCAS的氨基端是一个对Ca2+低亲和但高结合的区域,每个BcCAS的氨基端能结合10~12个Ca2+,定位于叶绿体的类囊体膜上调节Ca2+水平[37-39]. 本试验中,施用钙肥提高了‘黑叶五月慢’和‘上海六月慢’植株中BcCAS家族基因的表达量,且BcCAS1和BcCAS2表达量在‘黑叶五月慢’品种中显著上调. Weinl等[39]报道了CAS受抑制的拟南芥在低钙时也能抽薹,但时间比野生型晚,说明CAS在植物生长发育中起着重要的作用,同时其Ca2+浓度比野生型高了40%,也暗示了植物可能借助CAS来调节Ca2+水平.
-
施钙可以显著提高‘黑叶五月慢’和‘上海六月慢’地上部和根系生物量,‘黑叶五月慢’和‘上海六月慢’生物量分别在0.6 g/kg和0.4 g/kg CaSO4·2H2O处理时最佳. 随着施钙水平的增加,两个白菜品种地上部和地下部的钙质量分数整体上表现为先增后减趋势,在0.6 g/kg CaSO4·2H2O处理下达到最大值. 转录组分析发现,两个白菜品种的对照和施钙处理的差异表达基因主要富集在细胞组分这一类别中,富集的代谢通路包括转运和分解代谢通路、信号转导通路、氨基酸的生物合成、氨基酸代谢和氮代谢等通路中. 施钙处理后,‘黑叶五月慢’和‘上海六月慢’的BcECA和BcCAS家族基因表达量上调. Pearson相关性分析结果表明,不同钙水平处理下白菜BcECA和BcCAS家族基因表达量与钙质量分数之间具有正相关关系.






 DownLoad:
DownLoad: