-
开放科学(资源服务)标识码(OSID):

-
硼是高等植物必需的微量营养元素之一,参与植物的光合作用、细胞壁的合成、糖的转化和运输等多种生物代谢过程[1]. 我国缺硼的耕地土壤多达3 000万hm2以上,其中土壤的硼含量由北向南、由西向东逐渐降低. 在降雨量充沛的南方,土壤缺硼现象更为严重,这也是限制地区作物高产和优质的因素之一[2-3]. 然而,在硼缺乏和硼过量之间存在一个相对狭窄的范围[4]. 适宜的硼用量才能促进作物生长发育,获得更高产量和品质.
甜度作为水果风味的重要组成部分,由糖含量、糖酸比和糖的类型决定. 果实中可溶性糖主要包括蔗糖、果糖和葡萄糖,3种糖的组成与比例对果实甜度有很大影响[5]. 番茄果实的甜度主要由葡萄糖和果糖的含量决定,果糖的甜度是葡萄糖的2倍,提高番茄中果糖的含量可以增加果实甜度,从而改善番茄果实风味[6]. 糖代谢涉及各种酶的复杂网络调节,蔗糖代谢是糖积累的关键因素,受蔗糖磷酸合酶(SPS)、蔗糖合酶(SS)和蔗糖酶(Ivr)的调控. 有反应的糖类及其衍生物主要参与糖酵解或糖转运,包括1-磷酸葡萄糖、6-磷酸葡萄糖、6-磷酸果糖和蔗糖等[7]. 有研究发现缺硼处理后参与碳水化合物的琥珀酸脱氢酶铁硫亚基、酮还原酶家族中的氧化还原酶上调表达;在高硼处理后参与碳水化合物代谢的肌醇单磷酸酶家族蛋白上调表达,主要参与了抗坏血酸和磷酸肌醇代谢[8]. 另外有学者在硼缺乏处理后的根中鉴定出389个差异表达的蛋白质,根据生物学功能特性,参与碳水化合物和能量代谢的蛋白质有53个,占比为13.6%. 其中大多数与碳水化合物代谢相关的差异表达蛋白在硼缺乏中上调,这些上调的蛋白质主要参与碳水化合物(淀粉和蔗糖)生物合成、糖降解、磷酸戊糖途径、三羧酸循环、乳酸发酵、乙醇发酵等过程. 这与硼缺乏会增加高等植物和藻类中的葡萄糖-6-磷酸脱氢酶(G6PDH),6-磷酸葡萄糖酸脱氢酶(6PGDH)和β-葡萄糖苷酶的活性结果一致[9-10]. 其中所有下调的蛋白质都位于糖酵解的下游,这意味着糖酵解在硼缺乏的根中受到抑制[11].
番茄红素是成熟水果中的主要色素,在抗氧化、清除自由基方面具有重要的作用[12]. 在高等植物的果实中,番茄红素的生物合成和代谢是一个复杂的过程,涉及一系列生理生化反应和各种基因的参与,其中类胡萝卜素生物合成途径基因的转录调控是番茄红素积累的关键机制[13]. 从转录组水平上研究硼对作物营养和风味品质的影响,有助于从宏观上整体把握硼对作物风味品质的影响及主要分子机制. 有研究发现,硼缺乏导致12种与碳水化合物代谢相关的蛋白质改变,这些蛋白质主要参与糖酵解、三羧酸循环和戊糖磷酸途径,在与糖酵解相关的9种改变的蛋白质中,有6种蛋白质下调,3种蛋白质上调[11]. 缺硼处理下嫁接在不同砧木上的纽荷尔脐橙参与叶绿素分解的基因、类胡萝卜素合成的基因、葡萄糖合成的基因等表达差异非常显著[14]. 硼毒胁迫下的大麦大部分差异表达产物与细胞壁、蛋白激酶[15]等有关. 以上研究结果都为从转录水平对植物响应硼处理的机制研究拓展了思路. 本试验基于课题组前期研究,以重庆地区番茄应用较为广泛的2个品种‘凯丰’和‘红丽’为试验材料,采用大田试验研究了硼诱导下2个番茄品种的转录代谢信息差异,以及硼对番茄果实糖代谢关键酶基因、番茄红素合成代谢关键酶基因表达水平的影响. 同时,采用Pearson分析方法,研究番茄果实糖代谢关键酶基因、番茄红素合成代谢关键酶基因表达与糖和番茄红素含量之间的相关性,以期为番茄品质改良提供资料积累.
HTML
-
该试验在日光温室进行. 供试土壤的基础理化性质包括: pH(水/土=1/1)为6.86,土壤有机质为10.78 g/kg,全氮为1.20 g/kg,碱解氮为161.00 mg/kg,有效磷为410.20 mg/kg,速效钾为397.30 mg/kg,有效硼为0.14 mg/kg;番茄品种为‘凯丰’和‘红丽’,‘凯丰’和‘红丽’的外形横径、纵径大小相似,在不同时期其果实糖含量相差很小,番茄红素含量亦相差不大.
-
本试验硼元素质量浓度参照郭世荣[16]研究,设置了5个质量浓度的硼砂(0、1、2、4和8 mg/L),硼元素质量浓度分别为0 mg/L、0.11 mg/L、0.23 mg/L、0.45 mg/L和0.90 mg/L,记作CK、B1、B2、B3和B4. 采用叶面喷施,硼砂喷施量为当地农户常规叶面肥用量,约为750 mg/hm2[17]. 每个处理重复3次,随机排列,每个重复1株.
番茄栽培种植日常管理由当地人员负责,管理一致. 在第一穗果膨大期开始喷施第一次,以后间隔2周喷施1次,总共喷施3次,所有处理中的喷洒都由同一个人进行. 在3次喷施过后,取第三穗成熟期果实,先用自来水冲洗干净,然后用去离子水清洗3次. 一部分鲜样用于糖和番茄红素测定;一部分放于超低温冰箱-80 ℃保存,用于测定果实硼形态;剩余样品在实验室干燥器105 ℃下杀青15 min,分离根、茎、叶和果实,60 ℃下烘干称质量,然后在配有塑料外壳和不锈钢刀片的家用混合器中均质粉碎,用于测得硼含量. 经实验分析,B2处理对番茄果实生长、营养及风味综合影响最大. 故选用CK、B2处理的‘凯丰’和‘红丽’2个品种番茄成熟期果实用于转录组分析.
-
pH采用土水比1∶1的方法测定;土壤有机质、全氮、碱解氮、有效磷、速效钾等基本理化指标用常规方法测定[18]. 采用高效液相色谱法测定糖组分及番茄红素含量[19-20].
-
成熟期番茄果实用于总RNA提取、mRNA纯化、cDNA文库构建及高通量测序,cDNA文库构建及高通量测序由深圳华大基因股份有限公司支持完成. 基本过程为: 用mRNA富集法对总RNA进行处理,用打断buffer把获得的RNA片段化,结合cDNA二链形成双链DNA,双链DNA处理过后进行PCR扩增、热变形成单链得到单链环状DNA文库,将检测合格的文库进行Ⅰllumina测序.
-
原始测序数据首先通过SOAPnuke 1.4.0软件去除接头及低质量的序列,之后利用Hisat 2.1.0将获得clean reads比对到番茄参考基因组,使用Bowtie 2将clean reads比对到基因组序列上,然后使用RSEM计算各个样品的基因表达水平. 通过DESeq 2软件进行样品组间差异表达分析,将满足|log2Fold Change|>1且FDR<0.05的基因定义为差异表达基因(DEG),并对差异表达基因进行GO(Gene Ontology)功能注释及KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析[21].
-
分别取‘凯丰’(代号KF)、‘红丽’(代号HL)2个品种番茄在CK、B2处理后的成熟期果实进行转录组测序. KF-CK、KF-B2、HL-CK和HL-B2分别获得47.33、47.33、47.33和46.74百万条Raw Reads. 原始测序数据去除接头及低质量的数据后,每个文库分别获得43.84~45.47百万条Clean Reads,进一步的高质量碱基统计发现Clean Reads的Q20和Q30分别在96.78%~97.80%和91.60%~94.15%之间. 将Clean Reads比对到番茄参考基因组上,比对率在86.63%~94.91%之间(表 1). 以上结果说明,测序数据对比较好,质量较好,可以进行下一步分析.
-
本试验番茄果实材料的总RNA采用北京全式金生物技术股份有限公司TransZol Up Plus RNA Kit抽提试剂盒提取,提取出的一部分RNA用于RNA的质量检测,剩余的RNA保存在-80 ℃冰箱中以待进一步纯化和反转录.
-
使用北京全式金生物技术股份有限公司反转录试剂盒(TransCript One-Step Gdna Removal and cDNA Synthesis SuperMix)进行RNA反转录. 首先去除残存基因组DNA,再按照试剂盒进行RNA反转录反应. 反转录所合成的cDNA置于-20 ℃条件下保存.
-
番茄糖代谢关键酶基因和番茄红素合成关键酶基因的qRT-PCR引物如表 2. 用ddH2O将反转录产物cDNA稀释3倍,荧光定量PCR采用Power Up TM SYBRTM Green Master Mix(Applied Bio systems,Vilnius,Lithuania)试剂盒以及荧光定量PCR仪(Quant Studio TM 1 System,USA)进行测量. 具体PCR反应程序为: 95 ℃预变性10 min,95 ℃变性30 s,60 ℃退火30 s,40个循环;60 ℃上升至95 ℃检测产物溶解曲线. 所有试验重复3次. 用2-ΔΔCT的方法计算目标基因的相对表达量,CT值表示荧光信号达到设定阈值所经历的反应循环数. 其中PCR反应体系如表 3所示.
-
试验数据采用平均值±标准差表示. 利用SPSS 25.0软件进行单因素方差分析(One-way ANOVA),采用Fisher least significant difference(LSD)检测法进行不同处理均值的差异显著性比较,显著差异水平为p≤0.05.
1.1. 试验材料
1.2. 试验方法
1.3. 测定指标与方法
1.3.1. 土壤基本理化性质、番茄糖组分、番茄红素及硼含量分析
1.3.2. 转录组测序
1.3.2.1. 总RNA提取、cDNA文库构建及Ⅰllumina测序
1.3.2.2. RNA-seq分析
1.3.2.3. 数据的质控与比对
1.3.3. 番茄果实糖代谢及番茄红素合成代谢关键酶基因表达研究
1.3.3.1. 总RNA提取与质量检测
1.3.3.2. RNA的纯化与反转录
1.3.3.3. 引物及目标基因的qRT-PCR分析
1.4. 数据处理与统计分析
-
糖是重要的营养成分,糖分的不同种类、含量、分布的时序和空间定位的变化对果蔬风味品质的形成具有非常重要的作用[6]. 由图 1a可知,在绿熟期,随着供硼水平的增加,‘凯丰’和‘红丽’2个品种番茄的蔗糖含量呈现先增加后减少的趋势. 在B2处理条件下,‘凯丰’蔗糖含量达到最大值,为25.71 mg/L,是对照的1.56倍;‘红丽’在B3处理下达到最大值,为25.66 mg/L,是对照的1.36倍. 在成熟期,低浓度硼处理B1对‘凯丰’蔗糖含量有增加作用,其他浓度的处理降低了蔗糖含量. ‘红丽’在B2处理下蔗糖含量低于对照,在其他处理下蔗糖含量都高于对照,在B3处理下达到最大值. 由图 1b可知,在绿熟期对‘凯丰’和‘红丽’的果糖含量的影响不一致. ‘凯丰’的果糖含量先增加后减少,在B3时达到最大值,为29.46 mg/L,是对照的1.20倍;‘红丽’的果糖含量先增加再减少然后再增加,在高浓度处理时,其果糖含量显著高于对照. 在成熟期随着供硼水平的增加,‘凯丰’和‘红丽’的果糖含量分别呈现先减少再增加后减少和先增加后减少再增加的趋势,‘凯丰’果糖含量在B3时达到最大值,为43.83 mg/g,是对照的1.12倍,‘红丽’果糖含量在B1时达到最大值,为39.03 mg/g. 由图 1c和图 1d可知,随着供硼水平的增加,番茄绿熟期果实的可溶性总糖含量和淀粉含量都呈现先增加后减少的趋势,与对照相比较,‘凯丰’的可溶性总糖含量在B2处理下具有显著性差异,是对照的1.09倍. 在成熟期,番茄的可溶性总糖含量和淀粉含量整体上都呈现先增加后减少的趋势,与对照相比,‘凯丰’和‘红丽’的淀粉含量各处理之间没有显著性差异. 以上结果表明,适宜的硼处理可以增加绿熟期、成熟期的番茄果实蔗糖、果糖、可溶性总糖和淀粉含量,且两个时期的变化趋势相似. 从整体上来看,B2处理对绿熟期、成熟期的‘凯丰’整体效果最好,B3处理对绿熟期、成熟期的‘红丽’整体效果最好.
-
番茄红素是成熟水果中的主要色素,在抗氧化、清除自由基方面具有重要的作用[12]. 有研究认为,番茄红素作为类胡萝卜衍生的香气化合物,可能是决定一些香气的关键代谢物质[24]. 为此进一步通过HPLC法研究硼处理对2个品种番茄的番茄红素含量的影响. 由图 2可知,随着供硼水平的增加,‘凯丰’在绿熟期和‘红丽’在成熟期的番茄红素含量都呈现先增加后减少的趋势. 在绿熟期,2个品种的番茄红素含量在各处理间都没有达到显著性差异,在成熟期,‘红丽’的番茄红素各处理间有显著性差异. 在绿熟期,与对照相比,‘凯丰’的番茄红素含量都在增加,在B2处理下达到最大值,为29.96 μg/g,整体上增加了0.1%~1.3%;‘红丽’在B2、B4处理下分别增加了0.6%和1.1%,然而‘红丽’的番茄红素含量在B1和B3处理下低于对照,但差异不显著. 在成熟期,‘凯丰’和‘红丽’的番茄红素含量都在B2处理下达到最大值,分别为245.80 μg/g和277.13 μg/g.
-
以|log2Fold Change|>1且FDR<0.05为差异基因筛选标准进行筛选,对差异基因进行统计分析(图 3a),结果表明,在‘凯丰’CK和‘凯丰’B2之间有20个差异基因(13个上调表达,7个下调表达),‘红丽’CK和‘红丽’B2之间有261个差异基因(100个上调表达,161个下调表达),‘凯丰’CK和‘红丽’CK之间有59个差异基因(45个上调表达,14个下调表达),‘凯丰’B2和‘红丽’B2之间有158个差异基因(73个上调表达,85个下调表达). 利用Veen图对差异基因进行分析,结果表明(图 3b),KF-CK-vs-KF-B2与HL-CK-vs-HL-B2存在共有差异表达,KF-CK-vs-HL-CK和KF-B2-vs-HL-B2存在2个差异基因表达.
-
为了进一步研究差异基因参与的代谢通路及生物学功能,对所有样本间差异基因进行GO分析. GO分类分析结果表明(图 4),在2个番茄品种中,这些差异表达基因均主要富集在代谢过程(Metabolic process)、细胞过程(Cellular process)、膜(Membrane)、膜组分(Membrane part)、催化活性(Catalytic activity)、结合(Binding)、生物调控(biological regulation)和生物过程调控(regulation of biological process). 如图 4a,在‘凯丰’品种中,差异基因富集在代谢过程、细胞过程、生物调控、生物过程调控、膜、膜组分、催化活性和结合的差异表达基因分别有4、4、2、1、6、6、9和7个;如图 4b,在‘红丽’品种中,差异基因富集在代谢过程、细胞过程、生物调控、生物过程调控、膜、膜组分、催化活性和结合的差异表达基因分别有45、38、20、16、42、38、65和75个.
-
为了分析DEG在果实发育过程中的功能,基于KEGG数据库对差异表达基因进行KEGG富集分析(图 5). 如图 5a,KF-CK-vs-KF-B2的差异基因被富集到12个通路中,除了主要富集在氨基酸的生物合成(Biosynthesis of amino acids),黄酮类生物合成(Flavonoid biosynthesis),苯丙烷生物合成(Phenylpropanoid biosynthesis),甘氨酸、丝氨酸和苏氨酸代谢(Glycine,serine and threonine metabolism),其他聚糖降解(Other glycan degradation)等代谢通路外,与番茄红素合成代谢相关的通路也呈现出显著富集,如泛醌和其他萜类醌的生物合成(Ubiquinone and other terpenoid-quinone biosynthesis). 如图 5b,HL-CK-vs-HL-KF的差异基因被富集在20个通路中,除了主要富集在植物-病原体相互作用(Plant-pathogen interaction),苯丙烷生物合成(Phenylpropanoid biosynthesis),氨基糖和核苷酸糖代谢(Amino sugar and nucleotide sugar metabolism),黄酮类生物合成(Flavonoid biosynthesis),丙氨酸、天冬氨酸和谷氨酸代谢(Alanine,aspartate and glutamate metabolism)等代谢通路外,与番茄红素合成代谢相关的通路也出现显著富集,如二萜生物合成(Diterpenoid biosynthesis). 与糖合成代谢相关的通路也呈现出显著富集,如戊糖磷酸途径(Pentose phosphate pathway)、柠檬酸循环(TCA循环)(Citrate cycle)和半乳糖代谢(Galactose metabolism)等.
-
通过转录组分析,结合番茄果实中糖组分含量差异,进一步检测了与糖分合成代谢相关酶基因AA、BA、NI、AI、SPS和SS的表达水平. 如图 6所示,在绿熟期,与对照相比,‘凯丰’AA基因表达量在B3处理时下调;‘红丽’的AA基因表达量整体上调,在B3、B4处理下提高了1.52、1.19倍. 与对照相比,绿熟期2个品种番茄的BA基因表达量都整体上调表达,是对照的1~3.43倍(‘凯丰’)和1~3.13倍(‘红丽’). 在成熟期,与对照相比,‘凯丰’AA基因整体上调表达,表达量先增加后减少,在B1、B2处理下分别是对照的2.06倍和3.33倍;‘红丽’的表达量先后减少增加,在B3下调表达. 成熟期2个品种番茄的BA基因都呈下调表达趋势.
由图 7可知,在绿熟期,2个品种的AI基因表达水平均随着供硼水平的增加而先上调再下调,分别在B3和B2处理下表达量最大,分别较对照提高了0.61、0.84倍;与对照相比,2个品种番茄的NI基因表达量均整体上调,表达量是对照的0.76~3.01倍(‘凯丰’)和0.5~1.79倍(‘红丽’). 在成熟期,2个品种番茄的AI基因、NI基因表达量整体下调,品种间差异显著.
由图 8可知,在绿熟期,与对照相比,‘凯丰’的SPS基因表达下调,‘红丽’表达上调;2个品种番茄的SS基因表达均上调,分别是对照的1~2.86倍(‘凯丰’)和1~6.3倍(‘红丽’). 在成熟期,‘凯丰’SPS基因表达量整体下调;‘红丽’的SPS基因表达水平在成熟期随着供硼水平的增加呈先降低后增加的趋势. 成熟期2个品种番茄的SS基因表达量均下调,分别在B1达到最小值0.56(‘凯丰’),B2达到最小值0.11(‘红丽’).
-
进一步检测与类胡萝卜素生物合成代谢途径相关的PSY、PDS、Z-ISO、ZDS、CrtISO、LYCB、LYCE基因的表达情况. 通过qPCR检测发现,硼对2个品种番茄果实绿熟期和成熟期的PSY、PDS、Z-ISO、ZDS、CrtISO、LYCB、LYCE基因的表达量有显著影响. 由图 9可知,在绿熟期,2个品种番茄的PSY表达量随供硼水平的增加整体呈先增加后减少的趋势(‘红丽’的B4除外). 与对照相比,‘红丽’PSY基因表达量在B2、B4分别上调了1.23倍和1.56倍. 在成熟期,2个番茄品种的PSY基因表达量变化趋势一致,基本趋于稳定. 在绿熟期,2个品种番茄的PDS基因表达量随供硼水平的增加呈现先增加后减少的趋势. 在绿熟期,与对照相比,‘红丽’PDS基因表达量上调,在B2处理时表达量上调了2.40倍,而‘红丽’PDS基因表达量在B3、B4处理下出现了下调. 在成熟期,2个品种番茄PDS基因表达量均下调,除了‘红丽’在B1处理外,但各处理变化不显著. 在绿熟期,2个品种番茄的ZDS基因表达量随供硼水平的增加均呈现先增加后减少的趋势. 在绿熟期,与对照相比,2个品种番茄的ZDS基因表达量分别上调了1~3.51倍(‘凯丰’),1~2.16倍(‘红丽’),‘凯丰’在B3达到最大值,‘红丽’在B2值达到最大值. 在成熟期,除了‘凯丰’‘红丽’的ZDS基因表达量分别在B2、B1处理时上调外,其余处理下调. 综上可知,2个品种番茄的PSY、PDS、ZDS基因表达量在绿熟期变化显著.
由图 10可知,与对照相比,‘凯丰’在两个时期CrtISO基因表达量下调,‘红丽’在绿熟期B2和B4上调,在成熟期B1上调,各处理间差异明显. 2个品种番茄的Z-ISO基因表达量在绿熟期随供硼水平的增加均先增加后减少. 2个品种番茄Z-ISO基因表达量分别在B1、B2处理时上调,在B4处理时下调;在成熟期,2个品种番茄果实Z-ISO基因表达量上调,其表达量分别在B3、B2处理下达到最大值,是对照的2.10倍(‘凯丰’)、2.11倍(‘红丽’).
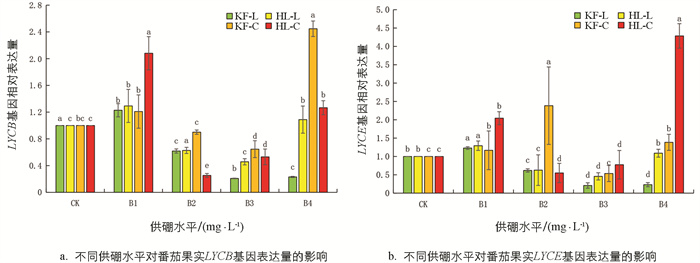
由图 11可知,‘凯丰’的LYCB基因表达水平除了在B1和成熟期B4上调,其余都下调. ‘红丽’的LYCB基因表达量在绿熟期较对照提高了0.45~1.29倍,在成熟期LYCB基因表达水平只有在B1、B4上调. 2个品种番茄的LYCE基因表达量变化趋势与LYCB基因相似.
综上所述,在适宜的硼处理后,绿熟期番茄的PSY、PDS、ZDS、CrtISO基因表达量上调,Z-ISO表达量在成熟期上调,LYCB和LYCE基因表达量整体上在绿熟期、成熟期下调,进而提高了番茄红素合成速率,降低了番茄红素转化速率,使番茄红素含量增加.
-
由表 4可知,在硼处理过后,番茄果实糖含量和糖代谢关键酶基因表达水平之间存在不同程度的相关性. 蔗糖与糖代谢关键酶相关基因表达水平呈负相关(-0.505≤r≤-0.360,AA除外),尤其与BA(r=-0.505)、NI(r=-0.504)和SPS(r=-0.476)呈显著负相关. 果糖与AA(r=0.259)呈相关,与其他基因表达水平呈负相关(-0.508≤r≤-0.332). 可溶性总糖与BA(r=0.626)、NI(r=0.567)的相关系数较高,呈极显著正相关. 可溶性总糖与AI、SPS和SS呈正相关(0.386≤r≤0.473),与AI(r=0.473)、SPS(r=0.463)呈显著相关. 淀粉与BA(r=0.711)呈极显著正相关,与NI(r=0.532)、AI(r=0.538)呈显著正相关,只与AA(r=-0.218)呈负相关.
-
为了探讨在硼处理下番茄红素含量与番茄红素合成代谢相关基因的表达量的相关性,本文进行了Person分析,相关结果如表 5所示. 番茄红素含量与PSY、CrtISO、 LYCB和LYCE相对表达量呈正相关关系,其相关系数分别为0.154、0.147、0.265和0.123,但相关性都未达到显著水平. 番茄红素含量与PDS、ZDS和Z-ISO相对表达量呈负相关关系,相关系数分别为-0.128、-0.347和-0.024,同时其相关性也都未达到显著水平.
2.1. 供硼水平对番茄果实糖分组分及含量的影响
2.2. 供硼水平对番茄果实番茄红素含量的影响
2.3. 差异表达基因的分析
2.4. 差异表达基因GO分析
2.5. 差异表达基因KEGG通路分析
2.6. 供硼水平对番茄糖代谢关键酶基因表达水平的影响
2.7. 供硼水平对番茄红素合成代谢关键酶基因表达水平的影响
2.8. 番茄糖代谢关键酶基因表达与果实糖含量的相关性研究
2.9. 番茄红素合成代谢相关基因与番茄红素含量的相关性研究
-
甜度作为水果风味的重要组成部分,番茄果实的甜度主要由葡萄糖和果糖的含量决定,果糖的甜度是葡萄糖的2倍,提高番茄中果糖的含量可以增加果实甜度,从而改善果实风味[5-6]. 不同发育期番茄果实糖分含量差异较大,为此对番茄果实在绿熟期、成熟期糖分含量进行了相关研究. 结果表明,适宜的硼处理(2 mg/L)能够提高绿熟期番茄果实中蔗糖、果糖和可溶性总糖的含量,而在成熟期,‘凯丰’和‘红丽’番茄果实中糖组分含量受到硼影响有差异,但总体上都是先增加后减少. 这与徐龙水[25]研究发现适宜硼肥能提高番茄中可溶性糖含量结论一致. Hegazi等[26]对橄榄果实喷施不同浓度硼肥,发现适宜的硼肥能提高可溶性总糖含量,其研究也与本文试验结果相同.
番茄红素是番茄果实的关键成分,因为它与番茄果实对人类健康的保护作用有关,并且主要负责番茄果实的红色. 番茄果实的番茄红素含量受栽培品种[27]、成熟期[13]、农艺因素[28]和加工的影响. 番茄红素裂解后会影响挥发性物质的合成,为此进一步检验了番茄果实中番茄红素的含量. 已有研究发现,叶面喷施硼肥会导致番茄果实中番茄红素含量、类胡萝卜素含量都呈先增加后减低的趋势[29]. 本文研究发现,在不同供硼水平处理下‘凯丰’和‘红丽’的番茄红素含量在绿熟期和成熟期表现出相似的变化趋势,均为先增后降,适宜的硼处理B2下能明显增加番茄红素含量,这与上述已有研究结果一致. 邵旭日等[30]在番茄叶面喷施不同浓度硒肥后,发现随着供硒水平的增加,番茄红素含量先增加(0~7 g)后减少(7~10 g),番茄红素也随着发育期的进行而积累,这与本研究结果一致. 另外Mallick等[31]通过基施硼肥也发现不同硼水平对番茄果实番茄红素含量的影响极显著(p<0.01),其中适宜硼处理(2.0 kg/ hm2)的番茄果实中番茄红素含量最高,为3.39 mg/100 g.
转录组代谢信息分析发现‘凯丰’(KF-CK-vs-KF-B2)和‘红丽’(HL-CK-vs-HL-KF)存在20和261个差异基因,在GO分析中,这些差异基因主要富集在生物过程,说明施硼后对番茄果实成熟期的物质代谢影响较大. 此外,差异基因还主要富集在催化活性、代谢过程和膜. 这与李巍[32]在低硼和正常硼处理的油菜品种差异表达基因研究中发现其主要富集在细胞膜、细胞核,分子功能主要涉及催化活性、转移酶活性一致. KEGG分析发现,差异基因共同富集在黄酮类生物合成、苯丙烷生物合成、氨基酸的合成代谢中. 番茄氨基酸合成代谢主要富集在甘氨酸、丝氨酸和苏氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,番茄红素合成代谢主要富集在泛醌和其他萜类醌的生物合成中,与糖合成代谢相关的通路也出现富集,如其他聚糖降解. 有研究发现,葡萄糖的合成基因(CsSIP、CsCWINV、CsTREH和CsTPS)、类胡萝卜素合成基因(CsCrtR-b和CsCrtL-e)表达的差异都非常显著,说明这些基因与脐橙应对缺硼胁迫有关[14]. 另有国外学者对硼毒胁迫下的大麦进行转录组学分析发现,根、叶组织中有16%~107%的转录产物是差异表达的,大多数与细胞壁、膜、蛋白激酶的形成及胁迫反应、转运机制有关[15].
果实成熟是一个复杂的过程,以碳水化合物的积累为特征,碳水化合物为果实提供能量并影响风味[33-34]. 糖是植物生长能量的碳源,在果实中转化为各种代谢物[35]. 各种生理、代谢和遗传过程综合导致糖分积累[36]. 蔗糖磷酸合酶(sucrose-phosphate synthase,SPS)通过糖代谢途径在控制蔗糖通量方面发挥着重要作用[37],它有助于番茄中蔗糖的积累和高糖含量的建立,在蔗糖积累过程中SPS表达水平增加进一步支持了这一结果[38]. 当蔗糖水解酶(AI、NI和SS)活跃时,蔗糖代谢增加,相应基因的表达水平受到调节[39]. 本研究进行适宜的硼处理后,在绿熟期,2个品种番茄的SS、NI、AI、BA和AA基因表达水平上调;在成熟期,这些基因表达量下调,但变化不显著. 这与已有的研究,不同酶的活性和与蔗糖代谢相关基因的表达水平与番茄收获后成熟过程中不同的糖水平(蔗糖、果糖和葡萄糖)一致的结果相同[40],这说明适宜的硼能够诱导糖分相应基因的表达水平. 同时,在本研究中发现糖含量与糖代谢关键酶基因表达水平之间的相关性是多种多样的,果糖、蔗糖整体上与相关基因的表达水平呈负相关,可溶性总糖与相关基因的表达水平呈正相关.
在高等植物的果实中,番茄红素的生物合成和代谢是一个复杂的过程,涉及一系列生理生化反应和各种基因的参与[41],其中类胡萝卜素生物合成途径基因的转录调控是番茄红素积累的关键机制[13]. 在本研究的前期,发现适宜的供硼处理明显增加了番茄红素含量的积累. 硼对番茄果实中番茄红素积累的分子机制尚未阐明,为此进一步研究了类胡萝卜素生物合成途径基因表达,发现适宜硼处理后番茄果实在绿熟期的PSY、PDS、ZDS和CrtISO的表达量增加,而在成熟期,各个基因表达量变化不大. Z-ISO基因表达量在绿熟期变化不显著,在成熟期显著上调表达,从而一定程度上促进番茄红素的积累. 此外,当番茄果实完全成熟时,全反式番茄红素转化为β-胡萝卜素和α-胡萝卜素,分别由番茄红素β-环化酶(LCY-β)和番茄红素ε-环化酶(LCY-ε)催化[42-43]. 在本研究中,适宜的硼处理(B2-B3)下调LYCB和LYCE的表达,降低了番茄红素的转化效率,从而减少了β-胡萝卜素和α-胡萝卜素的含量. 有其他的研究也证明了只有适宜的胁迫才能明显上调番茄红素合成基因的表达,同时会下调LYCB和LYCE基因的表达[44]. 在本试验中番茄果实番茄红素含量与PSY和CrtISO基因表达呈正相关,与PDS、ZDS和Z-ISO基因表达呈负相关. 这与刘英明等[45]研究结果一致,番茄果实中番茄红素含量与PSY基因表达量呈显著正相关(p<0.05),对于番茄红素和PDS、ZDS和Z-ISO基因表达呈负相关,这可能与硼胁迫水平有关.
-
微量元素硼参与作物的光合作用、细胞壁的合成、糖的转化和运输等多种生物代谢过程. 本试验中,随着供硼水平的增加,2个品种番茄的小区产量均呈现增加趋势,‘凯丰’和‘红丽’产量分别较对照提高了27.3%~67.2%和22.2%~86.2%. ‘凯丰’蔗糖含量在1 mg/L硼砂处理时达到最大值,而‘红丽’在2 mg/L硼砂处理时达到最大值. 在成熟期,‘凯丰’和‘红丽’的番茄红素含量在1 mg/L硼砂处理时达到最大值. 转录组分析发现,硼诱导下2个番茄品种的差异表达基因主要富集在生物过程中,涉及黄酮类生物合成、苯丙烷生物合成和氨基酸的代谢,部分差异基因还富集在番茄红素合成代谢通路和糖分合成代谢通路上. 在绿熟期,2个品种番茄的糖代谢关键酶基因AA、BA、NI、AI、SPS和SS基因表达量整体上调,番茄红素合成关键酶基因PSY、PDS、ZDS、CrtISO基因表达量在绿熟期上调,Z-ISO基因表达量在成熟期上调,相关分析显示,可溶性总糖与BA、NI基因的表达水平呈正相关,番茄红素含量与PSY、CrtISO基因表达量呈正相关.
















 DownLoad:
DownLoad: