-
开放科学(资源服务)标识码(OSID):

-
肿瘤微环境因其具有一些独特的理化性质而受到研究人员的广泛关注,例如乏氧、酸性微环境,高表达H2O2和高表达肿瘤细胞分泌物等. 其中,肿瘤微环境乏氧被认为是能直接影响肿瘤进展和肿瘤治疗的一大难题. 研究表明,肿瘤微环境乏氧能够促进肿瘤细胞生长增殖和转移,并且活性氧(ROS)介导的氧化应激疗法也受肿瘤乏氧所抑制,因此乏氧的解除对肿瘤治疗至关重要[1-4]. 例如,缓解肿瘤乏氧能够增强化疗疗效,氧气的供应还能促进光动力和声动力等需氧反应的活性等.
近年来,已经开发了多种基于纳米材料的抗肿瘤治疗方法,比如光热疗法[5-9]、声动力疗法[10-11]、化学动力疗法[12-14]和纳米酶催化疗法[15-17]等. 但是,单一的疗法往往难以起到彻底根除肿瘤的目的. 因此,多模式协同疗法因其具有使用尽可能少的纳米药物就能起到多重抗肿瘤疗效的特点而受到广大科研人员的青睐. 目前已经开发了各种具有多种功能协同抗肿瘤的纳米药物[18-22]. 然而,这些抗肿瘤纳米药物在兼顾了多种治疗模式的同时,其对机体的潜在毒性不可忽略. 因此,在设计开发这类多模式协同治疗的纳米粒子时,科研人员还需兼顾其安全性与应用转化价值.
基于此,本研究设计了一种结构简单的IrO2@SF纳米粒子(IOS),其具有多重抗肿瘤效应,同时其稳定的结构和较为安全的原材料还决定了其较高的生物安全性. 相较于已报道过的IrO2基纳米粒子具有的光热效应[23],本研究合成的IOS还具有较高的类过氧化氢酶活性、过氧化物酶活性和声动力活性. 同时,从天然蚕茧提取的丝素蛋白(SF)还赋予了IOS较高的生物相容性. 与传统基于牛血清蛋白(BSA)为模板进行矿化制备无机纳米颗粒相比,SF具有成本低、安全性高、具有免疫活性等性能优势. 经过一系列的研究表明,本研究合成的具有多模式协同治疗效应的IOS能够逆转肿瘤微环境的乏氧状况且具有较高的抗肿瘤活性. 同时IOS还具有良好的生物安全性,使其具有极高的临床转化潜力.
HTML
-
仪器:场发射扫描电子显微镜(JSM-7800F),紫外可见分光光度计(UV-1800),傅里叶变换红外光谱仪(FT-IR Nicolet 6700),X射线粉末衍射仪(Rigaku Smartlab),X射线光电子能谱仪(Thermo Kalpha),共聚焦激光显微镜(Zeiss LSM 800),倒置荧光显微镜(IX73).
试剂:二水合氯化钙(CaCl2·2H2O,AR)、碳酸钠(NaCO3,AR)和氯化铱(IrCl3,AR)购自上海阿拉丁公司. 氢氧化钠(NaOH,AR)购自美国Sigma-Aldrich公司. MTT细胞活力测定试剂盒、双醋酸荧光素(FDA,>97%)、碘化丙啶(PI,>94%)和Hoechst 33342(HPLC)由美国赛默飞世尔科技公司提供. 所有试剂都可直接用于实验.
-
第一步对蚕丝进行脱胶,先将家蚕茧在质量分数为0.5%的Na2CO3溶液中煮沸30 min(100 ℃),随后得到絮状白色丝素蛋白,将絮状丝素蛋白用去离子水洗涤并烘干. 然后将得到的1 g丝素蛋白加入到125 mL的Ajisawa溶液中(CaCl2·2H2O∶CH3CH2OH∶H2O,摩尔比为1∶2∶8),再加热2 h(90 ℃). 最后将溶液透析3 d,以去除杂质,最后得到纯净的丝素蛋白溶液.
-
首先在8 mL丝素蛋白溶液(15 mg/mL)中加入2 mL IrCl3水溶液(50 mmol/L),室温搅拌30 min. 然后用2 M NaOH将溶液pH值调到12,再加热搅拌12 h(80 ℃). 最后用去离子水透析24 h即得到IOS.
-
通过亚甲基蓝(MB)、邻苯二胺(OPD)和3,3′,5,5′-四甲基联苯胺(TMB) 3种比色试剂对IOS的过氧化物酶活性和声动力效果进行探究. 分别将不同药物与MB、TMB和OPD在室温下共同孵育15 min,其中分组为:① H2O2,② IOS,③ IOS+H2O2,④ IOS+H2O2+L和⑤ IOS+H2O2+U. IOS和H2O2的浓度分别为400 μg/mL和10 mmol/L;激光波长、功率和时间分别为:1 064 nm,1.5 W/cm2,5 min;超声功率和时间分别为:1 MHz,1 W/cm2,50%空占比,5 min. 反应结束后使用紫外可见分光光度计分别测量在652 nm(TMB),665 nm(MB)和492 nm(OPD)的光吸收变化情况.
-
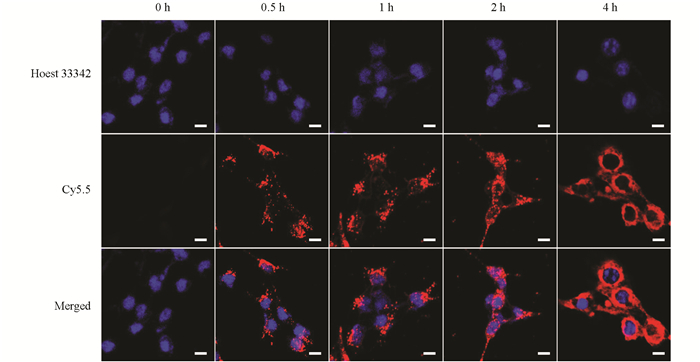
小鼠乳腺癌细胞4T1对IOS的内吞作用,通过共价偶联的方式将Cy5.5与IOS进行连接. 将EDC/NHS活化的Cy5.5(1 mg/mL)与IOS(200 μg/mL)在室温下搅拌6 h,然后通过离心(1×104 rpm,5 min)去除未反应的Cy5.5,再用去离子水多次洗涤得到Cy5.5标记的IOS. 随后用共聚焦激光显微镜观察IOS的细胞摄取情况. 简单地说,将4T1细胞在12孔板(每孔7 × 104个细胞)中培养12 h(37℃),然后在不同时间点(第0,0.5,1,2,4 h)加入Cy5.5标记的IOS(200 μg/mL). 用Hoest 33342染色20 min后,在共聚焦激光显微镜下进行观察拍摄.
-
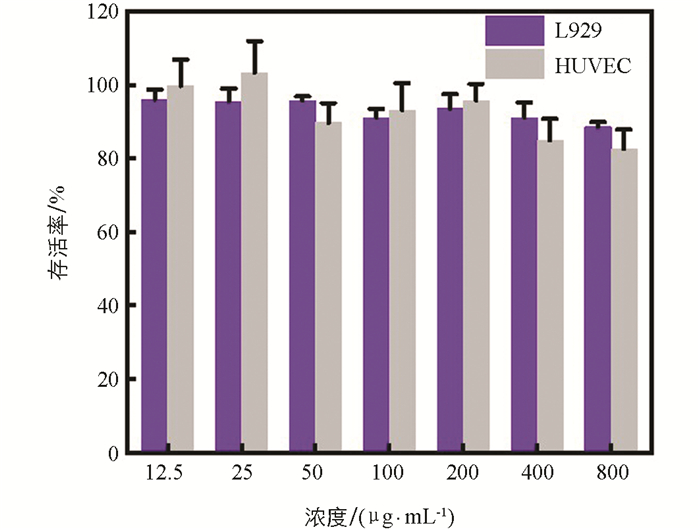
以小鼠成纤维细胞(L929)和人脐静脉内皮细胞(HUVEC)为实验对象,通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)测定IOS对正常体细胞的细胞毒性. 简单地说,将96孔板上的细胞(每孔1×104个细胞)分别用不同剂量的IOS(0~800 μg/mL)处理24 h,PBS冲洗后,用MTT(100 μL,0.5 mg/mL)孵育4 h,吸取掉培养基后用二甲基亚砜(DMSO)(100 μL)溶解蓝紫色结晶甲臜,在摇床上摇晃15 min后使用酶标仪测其在490 nm下的吸收光强度.
-
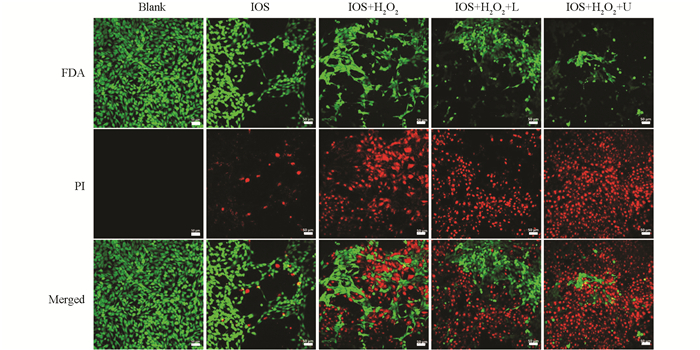
通过活/死差异荧光染色研究IOS的抗肿瘤活性. 将4T1细胞置于12孔板(每孔5×104个细胞)中,在37 ℃下培养12 h. 然后使用不同分组的药物与细胞进行共孵育培养4 h. 药物分组为:① H2O2,② IOS,③ IOS+H2O2,④ IOS+H2O2+L和⑤ IOS+H2O2+U. IOS和H2O2的浓度分别为400 μg/mL和10 mmol/L;激光波长、功率和时间分别为:1 064 nm,1.5 W/cm2,5 min;超声功率和时间分别为:1 MHz,1 W/cm2,50%空占比,5 min. 在第4 h分别使用激光光源和超声声源对第4组和第5组细胞进行处理,之后所有细胞继续培养2 h. 随后细胞经钙黄素-AM/碘化丙啶(PI)共染色15 min后,在荧光显微镜下观察和拍摄.
1.1. 实验仪器与试剂
1.2. IOS的合成
1.2.1. 丝素蛋白溶液的提取
1.2.2. IOS的合成
1.2.3. IOS的产ROS检测
1.2.4. IOS的细胞摄取实验
1.2.5. IOS的细胞相容性
1.2.6. IOS体外细胞毒性实验
-
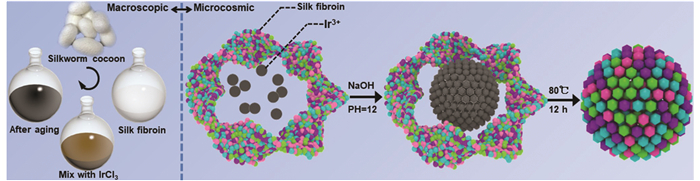
首先从家蚕茧中提取出SF,由于SF表面的羧基和氨基对Ir3+具有较好的亲和性,因此通过NaOH调节pH来促使Ir3+吸附于SF上,最后经过12 h反应得到终产物IOS(图 1). 扫描电镜显示所合成的IOS为80 nm左右的团簇状结构(图 2),而这种尺寸的纳米粒子在进行体内抗肿瘤治疗时具有较好的增强渗透滞留效应(EPR).
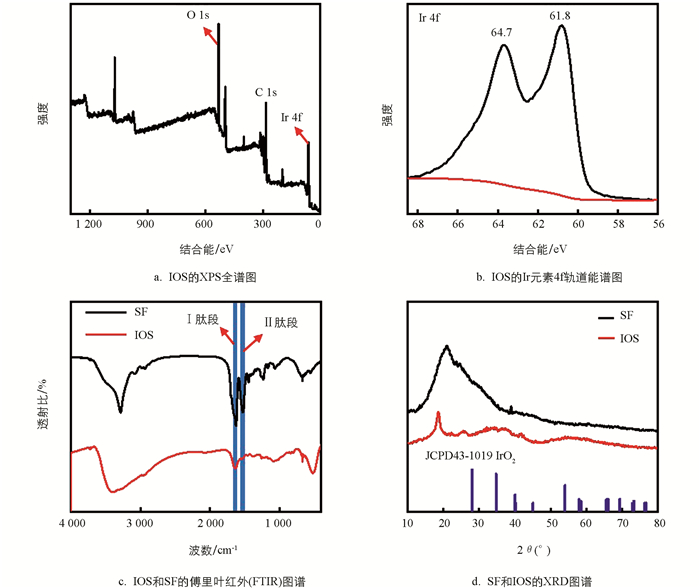
为了确认矿化在SF上的物质为IrO2,通过X射线光电子能谱(XPS)图谱进行元素分析. XPS总谱中存在的C,O和Ir元素初步证明了IrO2的存在(图 3a). 而Ir 4f轨道XPS谱在64.7 eV和61.8 eV处显示了2个特征峰分别归属于Ir 4f5/2和Ir 4f7/2,进一步说明IOS的成功合成[24](图 3b). 同时,通过傅里叶红外光谱对SF和IOS进行分析(图 3c),SF在1 651 cm-1和1 511 cm-1处的特征峰分别对应于SF的Ⅰ肽段和Ⅱ肽段,在IOS中也能看到相应的特征峰,这证明了IOS中保留了SF的活性蛋白肽段. 而IOS对SF活性肽段的高保留对提高纳米粒子的细胞相容性至关重要,同时这可能也是IOS在后续展现优异的酶活性、光热以及光动力性能的关键原因. 进一步,通过X射线衍射研究了SF和IOS的结构. 在对SF和IOS的XRD图谱分析中(图 3d),可观察到IOS的特征峰与IrO2的标准卡片JCPD43-1019相对应,同时IOS也保留了SF的特征峰,而IOS上SF特征峰的偏移可能与IrO2矿化层相关. 以上实验结果证明了IOS的成功制备,IOS较好地保留了SF的活性肽片段,这也为后续对IOS的性能探索提供了必要的理论基础和实验依据.
-
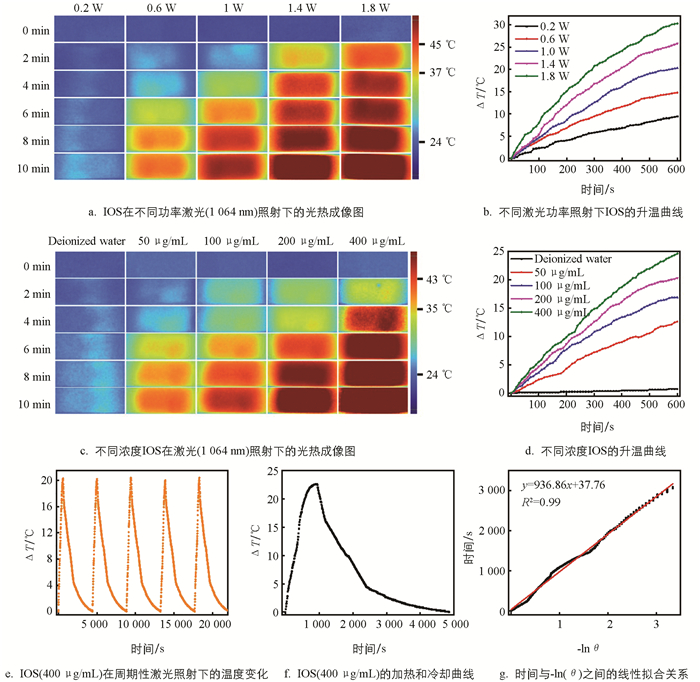
基于IOS的成功制备,本文首先探索了其光热转换能力. 在不同激光功率照射下检测了IOS的升温情况(图 4a、4b). 在1 W/cm2的激光功率下,10 min时IOS的温度就能超过45 ℃,且随着IOS的浓度升高,这种IOS的升温速率也会明显加快;用1.8 W/cm2的激光照射时,仅经过4 min,IOS就已达到45 ℃. 较快的升温速率为后续进行光热治疗奠定了基础. 进一步,在近红外光(1 064 nm,1.8 W/cm2)照射下,随着IOS浓度升高,IOS的升温速率也逐步加快,展现出明显的材料浓度依赖性(图 4c、4d). 通过光热循环测试鉴定了IOS的光热稳定性. 简单地说,IOS(400 μg/mL)溶液在经过5次光热循环测试后,依然保持了良好的光热效果,光热升温速率并无明显衰减(图 4e),这说明IOS的光热稳定性较好,可在需要多次反复光热治疗的场景中应用. 为了量化IOS的光热效率,进一步计算得到IOS的光热转化效率达到了35.64%(图 4f、4g),这说明IOS光热转化性能优异,在应用于抗肿瘤光热治疗制剂方面具有较高潜力.
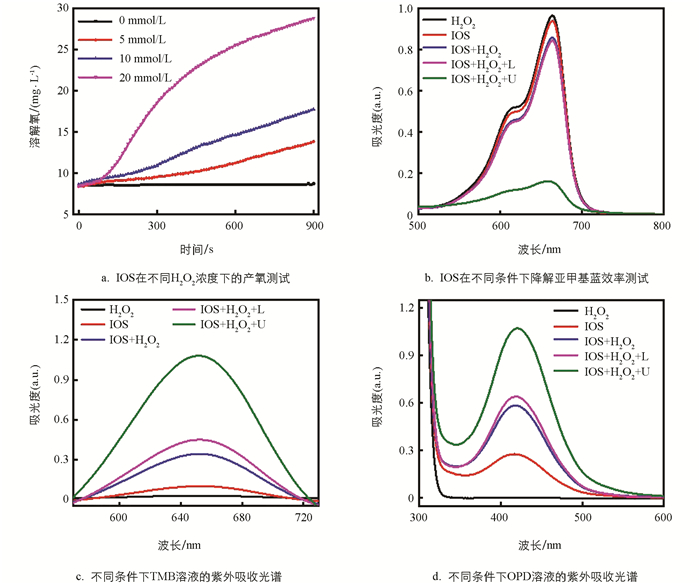
为了探索SF的加载是否给IOS带来了其他抗肿瘤相关的活性效果,进一步对IOS的类酶活性以及声动力效果进行了研究. 首先使用400 μg/mL的IOS与不同浓度H2O2反应,并使用溶氧仪记录溶液中的溶解氧含量,在测试的15 min内随着H2O2浓度升高,IOS催化过氧化氢分解产氧不断增强,这证明了IOS具有类过氧化氢酶活性(图 5a). 因此可推断IOS能催化肿瘤微环境中过表达的H2O2来产生氧气,从而缓解肿瘤部位的缺氧情况. 而在使用邻苯二胺(OPD)、3,3′,5,5′-四甲基联苯胺(TMB)以及亚甲基蓝(MB)进行的比色实验中,IOS又展现出了优异的类过氧化物酶活性以及声动力效果. 由于MB在遇到ROS时会被氧化,此时MB会由蓝色慢慢褪色,基于此,可通过紫外可见分光光度计测量MB在665 nm处的吸光度变化来定量ROS的产生情况. 在单独的“H2O2”和“IOS”组中,MB在665 nm处吸光度值并无太大差别,但当使用“IOS+H2O2+U”组时,MB的吸光度值显著下降,这说明IOS在超声下产生了大量的ROS(图 5b),因此可以推测IOS具有较好的声动力效果. 值得注意的是,“IOS+H2O2”组的MB在665 nm处也有轻微下降,可推测这是由于IOS具有类过氧化物酶活性产生的,IOS通过催化H2O2氧化MB,从而使得MB褪色. 上述结果说明IOS极大可能具有类过氧化物酶活性和潜在的化学动力学效应. 随后在使用TMB(652 nm)和OPD(492 nm) 2种比色试剂进行测试时,测试结果也与MB结果趋势一致(图 5c、5d),这更加证实了上述结论,即IOS具有优异的类过氧化氢酶活性、类过氧化物酶活性以及光动力效果,这为后续的细胞实验奠定了理论依据.
-
鉴于IOS展现出了优秀的光热、光动力以及酶催化活性,进一步探索了IOS的体外抗肿瘤性能. 在开展细胞实验时首先探索了肿瘤细胞对IOS的吞噬情况. 使用Cy5.5荧光染料标记IOS,分别在第0,0.5,1,2,4 h将Cy5.5标记的IOS加入到鼠乳腺癌4T1细胞中共同孵育,然后使用共聚焦激光显微镜观察Cy5.5的荧光情况,以评估4T1细胞对IOS的摄取效率. 显然随着纳米粒子与细胞共孵育的时间延长,细胞内纳米粒子的红色荧光也越强(图 6),说明IOS能够被4T1细胞正常摄取,这为后续的细胞实验提供了必要条件. 而IOS作为一种抗肿瘤药物,其安全性是需要首先评估的. 因此,利用人脐静脉内皮细胞(HUVEC)和小鼠成纤维细胞(L929)探索了IOS的毒性(图 7). 使用不同浓度的IOS(12.5,25,50,100,200,400,800 μg/mL)与HUVEC和L929孵育24 h,然后通过标准MTT法检测细胞活力. 结果显示,尽管使用了高达800 μg/mL的IOS处理了24 h,HUVEC和L929的细胞存活率都在80%以上,这说明IOS对正常细胞不具有明显的细胞毒性.
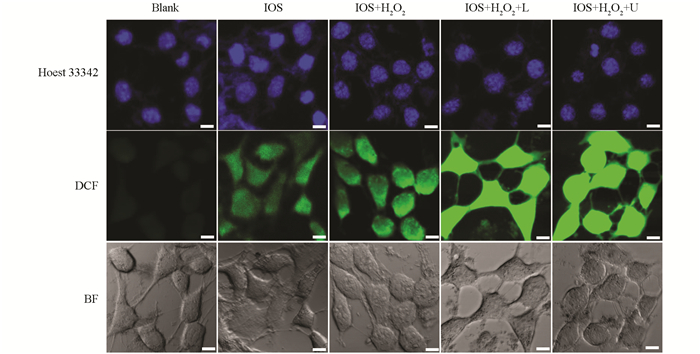
由于IOS具有良好的生物相容性和被4T1细胞吞噬的能力,进一步检测了IOS作用于肿瘤细胞后的胞内ROS水平,使用DCFH-DA活性氧荧光探针分析了不同处理组的ROS产生情况(图 8). “IOS”组有较弱的绿色荧光,这归因于IOS催化肿瘤细胞内源性H2O2产生了·OH. “IOS+H2O2+U”组的绿色荧光最强,是因为IOS的声动力效果与IOS的类过氧化物酶活性的双重作用下,产生了大量的ROS. 而“IOS+H2O2+L”组也展现了较强的绿色荧光,可能是因为光热加速了IOS的酶催化效率.
为了证明IOS的抗肿瘤作用,通过使用二乙酸荧光素和碘化丙啶(FDA/PI)染色活细胞和死细胞来判断IOS的癌细胞杀伤效果(图 9). 4T1细胞的活/死染色结果与ROS检测结果相对应,“IOS+H2O2+U”组的红色荧光信号最强,而“IOS+H2O2+L”组的效果次之,这证明了IOS的强效抗肿瘤作用. “IOS+H2O2+L”也展现了不错的肿瘤杀伤作用,归因于IOS的光热和类过氧化物酶活性双重作用. 这些实验结果表明,IOS能在4T1细胞造成大量ROS累积,并且不论是通过光热治疗还是通过声动力治疗都能造成4T1细胞的大量死亡,这预示IOS将会是一种性能优异的抗肿瘤纳米药剂.
2.1. 材料表征
2.2. 性能表征
2.3. IOS体外抗肿瘤研究
-
本研究成功制备了IrO2@SF纳米粒子,并在此基础上探究了其各项抗肿瘤活性. 实验结果表明IOS具有高效的光热转化效率,实际计算其光热效率达到了35.64%. 此外,IOS还具有较强的类过氧化氢酶活性、类过氧化物酶活性以及声动力效果. 通过体外的光热或声动力结合IOS的酶催化效应进行抗肿瘤实验,都取得了优异的抗肿瘤效果. 基于IOS的多模式协同治疗有望在体内研究中达到彻底消除肿瘤的目的. 总而言之,IOS是一种能够有效杀伤肿瘤细胞且生物相容性良好的抗肿瘤纳米材料,具有广阔的临床转化前景和商业化价值.







 DownLoad:
DownLoad: