-
大叶茜草(Rubia schumanniana Pritzel)为茜草科茜草属多年生草本植物,主要生长在西南地区,它不需要取出根茎能够直接用药,俗称破血丹、粘粘或者锯锯草.除此之外,由于其活血功能旺盛,不同时期不同药典记载的名称还有红丝线[1-3]等.我国于2010年出版的《中国药典》第一部中药部分对其功能进行了详细阐述,其性征偏寒凉,味道略苦,药物作用主要定位于肝脏,具有活血化瘀、减缓血液流速、疏通经络的功效,可以被用来治疗各种出血、吐血、经络闭塞、关节肿痛等症状[4],尤其是对于年龄较大的患者而言,对其心脏、脑血管等方面的疾病有很好的效果[5].现代研究表明它所含成分具有抗炎、抗肿瘤、消除结石、抗辐射、镇咳祛痰等作用,具有很高的药用价值.大叶茜草作为一种根和根状茎入药的常用中药材,其主要的药用化学成分有很多,其中对于大叶茜草素、蒽醌、糖苷类化合物、环己肽类化合物、多聚糖类、萜类化合物等有效成分的疗效已经有很多文献报道,然而对于从其中提取出的挥发性精油的作用机理研究还不足.本试验以重庆地区广泛生长的大叶茜草为原料,分析了大叶茜草挥发性物质的抑菌和抗氧化活性.
HTML
-
大叶茜草采摘于重庆永川区.
主要试剂:庆大霉素,二甲基亚砜(DMSO),DPPH,ABTS+·,购于美国Sigma公司;NaCl,NaOH等均属于分析纯级.
供试菌种:金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillus subtilis)、沙门氏菌(Salmonellatyphimurium)、大肠杆菌(Escherichia coli)、志贺氏菌(ShigellaCastellani),所有菌种都是从中国兽医微生物菌种保藏中心(China Veterinary Culture Collection Center,CVCC)购买得来.
-
722型单光束紫外可见分光光度计,现科分光仪器有限公司(上海).
-
依据权美平等[6]的提取方法稍有变动.
采摘新鲜的大叶茜草样品自然风干,留取根茎,粉碎均匀过30目筛,称取干粉约20±0.2 g,蒸馏水浸泡过夜,置于500 mL圆底烧瓶中,向瓶中加入约250 mL蒸馏水,并使用酒精灯进行加热,通过冷凝管回流提取并收集挥发出的油性物质,直到得到的产物基本无变化后停止提取;然后使用正己烷有机试剂对油性产物进行液液萃取分离并收集,将收集产物通过无水硫酸钠进行充分干燥最终得到黄色片状的固体精油,置于-40 ℃冰箱中贮存备用.
精油的稀释和准备:用电子天平精确称量100±0.2 mg的精油于容量瓶中,使用10 mL DMSO溶剂进行溶解,达到溶液初始母质量浓度为10 mg/mL,再以DMSO为稀释剂进行不同浓度的稀释,配置质量浓度在0.1~10 mg/mL的精油溶液.
-
固体培养基:使用电子天平分别称量牛肉膏3 g,蛋白胨10 g,NaCl粉末5 g于1 000 mL的烧杯中,加入蒸馏水至刻度线,边搅动边加热促进溶解,使用配置好的0.1 mol/L NaOH试剂将pH值调至7.4~7.6,最后添加15 g琼脂粉,不断搅和均匀后将其进行加温至煮沸使两者得到充分的融合,将融合后的混合液分别置于250 mL锥形瓶中,置于高压灭菌锅中,121 ℃,20 min灭菌.
-
取1 mL含试验菌种的甘油,无菌条件下接于150 mL灭菌过的液体培养基中,于37 ℃恒温培养24 h.将活化后的菌种在固体培养基中划线后37 ℃培养24 h,挑取单菌落接于250 mL已灭菌的液体培养基中,37 ℃培养24 h,制得试验菌悬液.
-
参考PRIYDARSHI R等[7]的滤纸片法.向提前准备好的无菌培养皿中添加10 mL琼脂,冷却至室温;固体培养基在高压灭菌后冷却至45 ℃,在无菌操作台中往里面添加1 mL试验菌株的混悬液,均匀混合;用移液器吸取15mL含供试菌株的培养基加入已冷却的琼脂培养基内,使用涂布棒进行涂布将其均匀平铺于培养皿中,用无菌镊子夹取直径为6 mm的滤纸片于培养基上,使用微量点样器吸取浓度为10 μL/mL的样液5 μL于滤纸片上,每个菌种3组重复.阴性对照组为DMSO空白溶剂,阳性对照组使用庆大霉素溶液,这两组添加量与样液相同均为5 μL.最后将培养基放置在37 ℃环境中过夜培养24 h,测量抑菌圈的直径,以平均值±标准差(x±SD)表示.
-
精油的稀释与准备:分别精确称取40 mg,80 mg的挥发油,加入10 mL DMSO,配制成初始质量浓度为4 mg/mL和8 mg/mL,然后将各个样品进行不同比例的稀释,所提炼出的目标化合物的质量浓度分别为0.016~2.000 mg/mL和2.0~8.0 mg/mL.准确称量100 mg,120 mg的目标化合物样品,分别添加10 mL DMSO,使得样品中所含目标化合物质量浓度为10 mg/mL和12 mg/mL,并将该物质进行储备备用.
-
参考符群等[8]的方法,略有改动.
首先需要以无水乙醇为溶剂,将DPPH进行溶解并制备成浓度为0.1 mmol/L的溶液,用移液管吸取3 mL置于烧杯中,并分别向其中滴加稀释后系列浓度的精油溶液各1 mL,搅拌均匀,于常温避光环境中静置40 min,吸收波长设置为517 nm,在该值内可检测到最大吸收峰,使用无水乙醇溶剂为空白对照组,设置对照试验,选择的试验对象为同一浓度的抗坏血酸试剂,且每次试验进行3次平行测定.
DPPH自由基清除率=(1-A1/A2)×100%
式中:A1为样品管的吸光值;
A2为对照管的吸光值.
-
参考Ozsoy N等[9]的方法,略有改动.
将0.2 mL不同浓度样液和1 mL磷酸缓冲液(50 mmol/L,pH值为7.4)混合,再加入1.8 mL H2O2试剂后,将其混合均匀,静置10 min后,在吸光度为230 nm处测定吸光值,选择磷酸缓冲液作为空白对比.
H2O2清除率=(1-A1/A2)×100%
式中:A1为样品管的吸光值;
A2为对照管的吸光值.
-
参照Xu等[10]的方法进行测定.
使用移液器精密吸取50 μL稀释后的样品溶液(阳性对照为维生素C),加入1.9 mL用甲醇稀释至734 nm处吸光度为0.700±0.050的ABTS+·应用液,摇晃混合均匀,将其放于常温、黑暗处中约6 min,然后在734 nm处检测其相对应的吸光度.
ABTS+·自由基清除率=(1-A1/A2)×100%
式中:A1为样品管的吸光值;
A2为对照管的吸光值.
-
参考Liu等[11]的方法进行还原力的测定.
精密量取pH值为6.6的磷酸缓冲液2.5 mL将其置于烧杯中,然后按顺序分别向其中添加系列浓度梯度的茜草精油溶液各2.5 mL,再将浓度为1%的铁氰化钾溶液分别吸取2.5 mL加入其中,摇匀,在50 ℃恒温水浴锅中充分反应30 min,冷却后添加2.5 mL浓度为10%的三氯乙酸液体,以3 000 r/min的速度离心10 min,取上清液5 mL,加蒸馏水5 mL和为0.1% FeCl3溶液1.0 mL,于700 nm处测定吸光度,同时进行空白试验.混合液的吸光度越高表示样品提取液的还原能力越强.
-
每个样品3次重复检测,数据处理与分析采用Excel和SPSS软件,结果以x±SD的形式表示,图表绘制采用Origin 8.6软件.
1.1. 试验材料
1.2. 试验仪器
1.3. 试验方法
1.3.1. 大叶茜草精油的提取
1.3.2. 抑菌活性
1.3.2.1. 培养基的配置
1.3.2.2. 菌种的活化与菌悬液的制备
1.3.2.3. 抑菌圈的测定
1.3.3. 抗氧化试验
1.3.3.1. 清除DPPH自由基
1.3.3.2. H2O2清除力
1.3.3.3. 清除ABTS+·活力
1.3.3.4. 还原力测定
1.4. 数据处理
-
大叶茜草精油的抑菌活性以产生的抑菌圈直径(inhibitory zone diameter,IZD)来表示.据文献报道,通常该种类型试验的判断标准[12]为IZD>15 mm,为最高型;范围为15 mm≥IZD≥10 mm,为中等类型;低敏感为9 mm≥IZD≥7 mm;无抑菌圈为不敏感.
表 1为大叶茜草精油发挥抑菌作用的效果.由表 1可知,阳性对照组庆大霉素的最小IZD为19.94±1.10 mm>15 mm,而阴性对照表现为无抑菌圈形成,因此可以判定庆大霉素对测试的5种供试菌很敏感,都表现出很强的抑制作用,而作为大叶茜草精油溶剂的DMSO对所有的供试菌均不敏感,没有表现出任何的抑菌作用.大叶茜草精油对革兰氏阳性菌(G+)中的金黄色葡萄球菌和枯草芽孢杆菌的抑菌圈直径分别为9.13±1.22 mm,6.18±1.01 mm;对革兰氏阴性菌(G-)中的沙门氏菌、大肠杆菌和志贺氏菌的抑菌圈直径分别为8.56±0.87 mm,6.62±0.37 mm和7.49±0.78 mm;大叶茜草精油对金黄色葡萄球菌、沙门氏菌和志贺氏菌有一定的抑菌作用,但是抑制效果不明显,属于低敏感;大叶茜草精油对枯草芽孢杆菌和大肠杆菌有抑菌圈形成,抑菌效果不明显.综合来看,对2种革兰氏阳性菌而言,对抑制枯草芽孢杆菌生长的效果最差,大叶茜草精油对金黄色葡萄球菌表现出较好的抑制作用;对3种革兰氏阴性菌而言,大叶茜草精油对沙门氏菌和志贺氏菌表现出较好的抑制效果,对大肠杆菌的抑制效果较差.可见大叶茜草精油对不同微生物生长繁殖的抑制作用有明显的差异.
-
DPPH是一种较为稳定的自由基,其在517 nm波长处有较强的吸光能力,当其与自由基或电子结合时,溶液颜色会由深紫色转化为淡黄色,吸光度值也跟着减小. DPPH自由基既能在短时内与许多样品进行融合,又对低浓度样品敏感,因此常用来检测诸如果蔬汁或其提取物自由基的清除能力[13].
使用维生素C作为阳性对照溶液,对多种浓度梯度下大叶茜草精油提取物对DPPH的清除效应进行比较,结果如图 1.由图 1可知,大叶茜草精油和维生素C对DPPH的清除效应与溶液质量浓度呈正相关,且可以明显看出该精油质量浓度在8 mg/mL以下时,其质量清除效应相较于维生素C差异较大;当该精油质量浓度为12 mg/mL时,其清除率可以达到(83.4±4.01)%,而当其质量浓度大于等于14 mg/mL时,清除率已接近饱和状态,为(83.6±1.97)%,与12 mg/mL时的清除率差异无统计学意义.维生素C的清除率在低质量浓度范围内量效关系增加明显,达到4 mg/mL后,维生素C对DPPH的清除能力随质量浓度的增加呈平稳不变趋势.樊梓鸾等[14]对红松松枝精油抗氧化活性进行测定,结果表明红松松枝精油能明显清除DPPH自由基,在精油质量浓度为12 mg/mL时清除率最大,为88.89%.
-
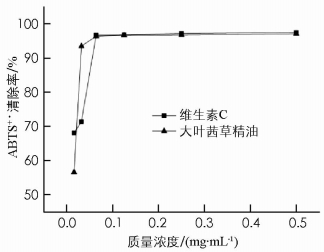
ABTS+·清除能力测定原理为二铵盐和过硫酸钾相互作用能够形成蓝绿色且在734 nm波长处有最大吸光度.若向该试剂中添加具有消除作用的自由基清除剂时,试剂颜色会逐渐变淡,在734 nm处所得到的吸光值也会变小,因此可依据吸光值的大小来判断自由基的清除效率[15].
不同质量浓度的大叶茜草精油和阳性对照维生素C对ABTS+·清除能力如图 2.从图 2中可以看出其消除的作用受质量浓度的影响,两者之间的关系呈现出浓度依赖型,且尤其在质量浓度较低的区域内浓度对于其效应影响较大;在低质量浓度范围(<0.063 mg/mL)内,大叶茜草精油对ABTS+·清除效应明显比维生素C要好;当大叶茜草精油在高质量浓度范围(>0.063 mg/mL)对ABTS+·清除能力基本与维生素C相当,主要体现在其高效的抗氧化特性上.大叶茜草精油质量浓度为0.063 mg/mL时其清除率为96.4%,略低于维生素C的96.7%,但差异无统计学意义(p>0.05).当质量浓度大于0.063 mg/mL时,两者之间的ABTS+·清除能力差异无统计学意义(p>0.05).因此,大叶茜草精油表现出较强的ABTS+·清除能力.
-
图 3表示的是不同质量浓度的大叶茜草精油和阳性对照维生素C对H2O2的清除能力.由图 3可知,大叶茜草精油的H2O2清除能力与质量浓度之间呈浓度依赖关系,维生素C的H2O2清除率始终低于大叶茜草精油.大叶茜草精油表现出较高的H2O2清除能力,当大叶茜草精油质量浓度为0.5~4.0 mg/mL时,大叶茜草精油对H2O2的清除能力随质量浓度的增加无显著性变化(p>0.05),且最大H2O2清除率为质量浓度为4 mg/mL时的96.1%.维生素C的H2O2清除率随着质量浓度的增加呈现上升的趋势,当质量浓度为4 mg/mL时达到最大,为63.6%.因此,大叶茜草精油具有较强的H2O2清除能力,且H2O2清除能力大于维生素C.
-
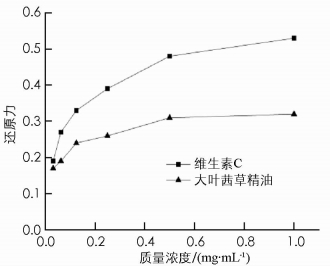
根据氧化还原反应的原理,若往溶液中加入具有还原能力的成分,则铁氰化钾中的Fe3+会被其还原成Fe2+,从而生成亚铁氰化钾(K4Fe(CN)6·3H2O),而在酸性环境中,K4Fe(CN)6·3H2O中Fe2+的能够与FeCl3中的Fe3+结合,经过化学反应产生普鲁士蓝,其在700 nm波长处吸光度值最高.由此可以看出,吸光度值的高低可以表现出样品溶液的还原性,且两者之间成正比关系[16].
图 4表示的是不同质量浓度的大叶茜草精油和阳性对照维生素C的还原能力.由图 4可知,大叶茜草精油和阳性对照维生素C的还原能力随质量浓度的增加均呈增加的趋势,说明在一定范围内,大叶茜草精油的质量浓度越大其还原力越强,但是大叶茜草精油的还原能力始终低于维生素C.维生素C与所试质量浓度呈剂量依赖效应,但是大叶茜草精油的剂量效应关系不明显.
2.1. 大叶茜草精油抑菌活性
2.2. DPPH清除能力
2.3. ABTS+·清除能力
2.4. H2O2清除能力
2.5. 清除还原力
-
本试验对5种供试菌进行抑菌试验,结果表明,大叶茜草精油对枯草芽孢杆菌和大肠杆菌抑菌性较差,对金黄色葡萄球菌、沙门氏菌和志贺氏菌表现出较好的抑制作用,大叶茜草精油对不同微生物生长繁殖的抑制作用有明显的差异.
精油的成分多且复杂[17-18],其中大多数都具有抗氧化的作用[19].有研究表明精油强的抗氧化活性强,足以解释此植物能治疗多种疾病的原因,即精油的天然抗氧化剂与药用植物的有益属性密切相关[20].本研究采用了多种方式对大叶茜草提取物—精油的抗氧化能力进行了分析.最终发现,该精油对于DPPH,ABTS+·以及H2O2具有良好的消除能力,但是与维生素C相比,其还原性还是较低.








 DownLoad:
DownLoad: