-
弓形虫脑炎(toxoplasmic encephalitis,TE)是艾滋病(acquired immunodeficiency syndrome,AIDS)患者最常见的神经系统机会性感染之一[1],随着抗逆转录病毒治疗(antiretroviral therapy,ART)及预防性磺胺类药物的广泛应用,TE的发病率呈下降趋势[2],但仍是严重威胁AIDS患者健康和生命的重要机会性感染.即使经过抗弓形虫治疗后,艾滋病合并弓形虫脑炎(acquired immunodeficiency syndrome/toxoplasmic encephalitis,AIDS/TE)患者住院病死率仍高达29.9%[3].
由于AIDS患者病情的特殊性、复杂性等原因,该类人群合并TE时具有相对特殊的临床特征,与非AIDS人群存在一定差异.然而,有关AIDS/TE的临床特征、诊断、治疗、ART启动时机和TE相关性免疫重建炎症综合征(toxoplasmic encephalitis associated immune reconstitution inflammatory syndrome,TE-IRIS)等尚缺乏系统的指南性文献可供参考.本共识在综合现有文献的基础上,结合本课题部分研究成果,就AIDS/TE的流行情况、发病机制、诊断、治疗和预防等方面进行详细阐述,以期为AIDS/TE的临床诊疗提供参考.
全文HTML
-
全球约1/3的人口血清弓形虫抗体呈阳性,弓形虫与人类免疫缺陷病毒(human immunodeficiency virus,HIV)共感染率在25.1%~60.7%之间,其中中等收入国家为34.2%[4].一项纳入全球研究的荟萃分析发现,AIDS患者弓形虫血清抗体(IgG)阳性率显著高于健康人群(46.1% vs. 36.6%)[5].另一项纳入927例病例的中国研究显示,AIDS患者弓形虫血清抗体(IgG)阳性率显著高于健康人群(35.1% vs. 23.7%)[6].据估计,在血清弓形虫抗体阳性的AIDS患者中,1/3最终会发展为TE [7].未接受预防性抗弓形虫治疗的HIV感染者,易发生弓形虫感染再激活而导致弓形虫病[8],其中以中枢神经系统疾病为最常见的发病形式[1].
-
猫科动物是最重要的传染源,其次为感染弓形虫的其他温血动物,如人类和鸟类等.弓形虫包囊和滋养体主要存在于这些宿主的肉尸、内脏、血液和排泄物中.
-
弓形虫感染的传播途径分为先天性和获得性.先天性是指虫体经母体胎盘垂直感染胎儿.获得性感染主要包括以下3种:①食入被弓形虫卵囊污染的食物或水;②摄入含有包囊的未熟肉类和生乳品;③输血、器官移植[9].一项研究证明,食用生贝类(包括生蚝、蛤蜊和蚌类)是弓形虫病急性感染的一个新危险因素[10].
-
人类对弓形虫普遍易感,尤其是胎儿、婴幼儿以及各种免疫功能低下或缺陷者,CD4+T淋巴细胞计数低于50个/μL的AIDS患者尤为易感[11].研究表明,AIDS/TE患者的CD4比单纯弓形虫感染者低12.6倍,且CD8显著下降3.3倍[12]. ART广泛应用后,弓形虫感染多在未启动ART者中发现[12]. AIDS/TE的高危因素包括感染HIV且未进行抗弓形虫预防性治疗、未启动ART或ART失败、CD4+T淋巴细胞计数<50个/μL、既往合并其他机会性感染等[11].
1.1. 流行概况
1.2. 传染源
1.3. 传播途径
1.4. 易感人群
-
弓形虫最早于1908年在北非突尼斯的一种啮齿动物刚地梳趾鼠中发现并命名,其发育全过程分为滋养体(包括速殖子和缓殖子)、包囊、裂殖体、配子体和卵囊5种生活史阶段,具有临床诊断价值的是速殖子和包囊[13].
-
弓形虫的致病机理与虫株毒力和宿主免疫状态相关.分离于欧洲和北美的弓形虫株属于3个克隆亚群谱系:Ⅰ型、Ⅱ型和Ⅲ型,在人体中可引起不同结局[14].我国的优势弓形虫基因型被命名为Chinese 1型,其与Ⅱ型属于同一分化支[15]. Chinese 1型存在强毒株和弱毒株,强毒株1 000个速殖子感染昆明小鼠30 d内死亡率达92.9%,而弱毒株感染小鼠的同期死亡率为45%[9].
弓形虫复杂的免疫逃逸机制使其能在机体中长期存在,引起慢性或长期潜伏感染.若宿主的免疫系统保持完整,则病原体在脑组织中形成的缓殖子将在宿主整个生命中保持休眠状态,呈无症状表型[16].一旦宿主免疫系统功能受损,缓殖子可通过未知的激活机制再次活跃,恢复到速殖子阶段,速殖子迅速释放并进入脑组织,从而引发急性感染[7],这也是免疫功能缺陷者(如AIDS患者、器官移植者等)常合并TE的主要原因之一.
对于AIDS患者而言,TE可由初始感染或再激活感染引起[17].初始感染中,大脑细胞因子在局部快速增加导致病理性脑炎.再激活感染中,慢性寄生性缓殖子于免疫系统功能下降时(以IFN-γ降低为标志)破裂,炎性细胞被募集到大脑,当免疫系统试图减轻感染时会导致破坏性肿胀.初始感染和再激活感染中,树突状细胞、巨噬细胞和嗜中性粒细胞产生的IL-12对刺激IFN-γ分泌以预防或改善TE都至关重要[18].有研究显示,AIDS/TE患者体内抗炎细胞因子IL-10和IFN-γ降低,提示免疫功能下调,利于虫体存活.同时,炎性细胞因子TNF-α水平增加,提示存活的虫体触发了炎性反应[19].
2.1. 病原学特点
2.2. 发病机制
-
TE可呈急性或亚急性起病,急性者脑损害呈弥漫性,亚急性者多为局灶性脑损害,后逐渐发展至脑部弥漫性损害,其临床表现因病灶部位与严重程度而各异[20].依据病灶发生的部位可分为脑室型、脑实质型和混合型.脑室型以颅内高压和脑膜刺激征为主要表现;脑实质型可出现癫痫、颅内高压、神智改变、感觉运动障碍、失语和脑神经损害等症状.按照病理组织学特征可分为局灶性坏死型、小胶质结节型、多发脑脓肿型和脑积水型.由于虫体可侵犯颅内多个部位,故TE临床表现较为复杂,没有较为特异性的临床表现. Vidal等[1]最新研究发现,AIDS/TE患者的临床症状及体征主要为头痛(38%~93%)、发热(35%~88%)、局灶性神经系统缺陷(22%~80%)、癫痫发作(19%~58%)、精神错乱(15%~52%)、精神运动或行为变化(37%~42%)、共济失调(2%~30%)、颅神经麻痹(12%~28%)和视觉异常(8%~19%).若不及时治疗,AIDS/TE可进展为癫痫发作、昏迷和死亡.除TE外,AIDS患者常合并其他中枢神经系统感染,临床表现更加复杂多样,易造成漏诊和误诊,影响预后.
HIV阴性的TE患者可合并除神经系统以外的其他系统弓形虫感染,如视网膜脉络膜炎、肺炎、心肌炎等,而上述表现在AIDS患者中并不常见[21]. Belanger等[22]分析了116例合并弓形虫病的AIDS患者,其中103例(88.8%)为TE,7例(6%)为弓形虫肺病,4例(3.5%)为弓形虫眼病,2例(1.7%)为播散性弓形虫病.近期一项研究显示,弓形体眼病可能是HIV感染发展为艾滋病期的最初表现,临床上可显示为单发性或多发性视网膜脉络膜病变[23].
-
一般以速殖子总提取物为抗原进行弓形虫抗体检测.血液、脑脊液和脑组织样本都可用于抗体检测[24].目前可采用多种方法进行抗体检测,如免疫金标渗滤法、染色试验(Sabin-Feldman dye test,DT)、改良凝集试验(modified agglutination test,MAT)、乳胶凝集试验(latax agglutination test,LAT)、间接血凝试验(indirect hemagglutination assay,IHA)、酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)、间接荧光抗体试验(indirect fluorescence antibody test,IFAT)等[25].研究显示,金标法、IHA、ELISA这3种方法对弓形虫IgG抗体检测的敏感性分别为85.5%,89.8%和91.9%,特异性分别为92.4%,96.6%和97.5%,差异均无统计学意义[26].由于抗原成分难以标准化、其他寄生虫污染等可导致检测敏感性和特异性的降低. IgG和IgM为弓形虫特异性抗体,其中IgG抗体最常用于实验室检测[25].弓形虫IgG抗体一般在感染后1~2周检测出阳性,可维持多年.大多数AIDS/TE患者血清IgG抗体呈阳性,而IgM抗体通常不呈阳性[11].当出现再激活感染时,IgM也可为阳性.由于免疫抑制,约5%的AIDS/TE患者血清中无法检测到抗体,故AIDS患者弓形虫特异性抗体检测存在一定的假阴性[27].
-
弓形虫抗原检测是早期诊断弓形虫感染的可靠方法,通常采用单克隆抗体夹心ELISA法检测宿主细胞内的病原体(速殖子或包囊)、血清及体液中的代谢或裂解产物(循环抗原)[25].但由于单克隆抗体筛选和制备的要求较高,对于弓形虫抗原检测目前尚无法推广应用.
-
通过聚合酶链反应(polymerase chain reaction,PCR)为基础的分子学检测方法,可在脑脊液、骨髓、血液、羊水、房水等标本中检测到弓形虫DNA.由于其敏感性不受患者免疫状态影响,故适用于AIDS患者[28].该方法特异性较高(96%~100%),但不同标本敏感性不一,脑脊液标本敏感性为35%~72%[28],血液标本为11.11%~22.22%[29].研究表明,抗弓形虫治疗会降低PCR结果的检出率[30],但预防性治疗不会导致检出率降低[31].与常规PCR相比,实时定量PCR、巢式PCR、环介导等温扩增PCR的敏感性和特异性更高[27].近期一项病例报道将宏基因组二代测序(metagenomic next generaton sequencing,mNGS)用于AIDS/TE诊断,该方法使用BGISEQ-50平台,将患者脑脊液的DNA提取物进行宏基因组测序并成功诊断[32].目前我国部分地区可开展此检测,但价格较为昂贵.
-
脑组织活检为TE诊断的金标准.通过瑞氏或姬氏染色镜检可找到弓形虫滋养体或包囊,但阳性率不高,免疫过氧化物酶染色可提高检测的敏感性[11].该操作有一定风险,临床实用性较低.
-
该检查无特异性,但可作为辅助诊断依据. TE患者脑脊液常规检查通常表现为以淋巴细胞为主的白细胞增高,并伴有嗜酸性粒细胞和蛋白质增高[33].有研究表明,约42.6%的AIDS/TE患者可出现脑脊液压力升高,66.0%的患者可出现脑脊液蛋白含量增加[34].
4.1. 特异性抗体检测
4.2. 特异性抗原检测
4.3. 核酸检测
4.4. 病原体检测
4.5. 脑脊液生化常规
-
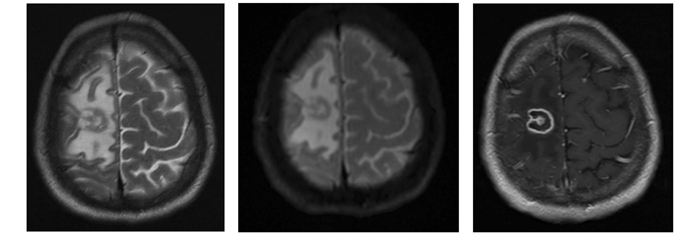
影像学是检出TE病灶的主要手段.依据病灶发生的部位,可分为脑室型、脑实质型和混合型. TE以双侧多发病灶为主,在一项AIDS/TE的影像学研究中,多发病灶占89.5%(51/57),而单发病灶占10.5%(6/57)[34].病灶的好发部位以基底节多见,也可见于额叶、顶叶、枕叶、颞叶、丘脑、脑干等[3].免疫功能正常人群可对弓形虫产生强烈免疫应答,引起对比度增强,影像学上多表现为位于皮质层的放射状强化病灶[7].在AIDS人群中,TE病变在影像学上呈境界清晰的环形强化,伴或不伴周围水肿,常为低密度或等密度,增强扫描后可出现靶样强化(图 1).
核磁共振成像(Magnetic Resonance Imaging,MRI)对TE的诊断敏感性优于计算机断层扫描(Computed Tomography,CT),能更好地显示病灶多发分布、环形偏心性强化等,在诊断与鉴别诊断上较CT具有一定优势[21].典型的MRI表现为颅内多发长T1和长T2信号;T1加权图像上呈现较小椭圆形低信号(其内可有小斑点状高信号),周围环绕水肿呈现高信号;T2加权图像上呈现较小的椭圆形低信号,内有点状高信号,周围水肿带呈高信号.
正电子发射计算机断层扫描(position emission tomography,PET)或单光子发射计算机断层扫描(single photon emission computed tomography,SPECT)可能有助于鉴别TE和原发性中枢神经系统淋巴瘤,但影像学检查不完全特异,故需结合临床表现、实验室检查进行诊断[11]. 2017年一项荟萃分析显示,SPECT区分TE和淋巴瘤的敏感性为92%,特异性为84%[35]. ART可能会影响SPECT对AIDS合并颅内局部性病灶患者的诊断,一项针对AIDS/TE患者的荟萃分析表明,已启动ART者比未启动ART者SPECT检查更易出现假阳性[36].
-
AIDS患者出现头痛、发热、意识模糊等非特异性颅内感染症状时需考虑该病. AIDS/TE临床诊断的依据包括:①严重免疫缺陷的AIDS患者,尤其当CD4+T淋巴细胞计数<50个/μL时;②临床症状及体征:取决于病灶部位与严重程度,可表现为头痛、发热、局灶性神经系统缺陷、癫痫发作、精神错乱、行为变化、共济失调、颅神经麻痹、视觉异常等;③实验室检查:抗弓形虫IgG抗体阳性,脑脊液检查通常表现为以淋巴细胞为主的白细胞增高,伴有嗜酸性粒细胞和蛋白质增高[33];④影像学检查:头颅CT或MRI可见境界清晰的环形强化伴或不伴周围水肿;⑤排除其他病原体感染或疾病引起的颅内病变;⑥抗弓形虫治疗有效.
既往研究表明在AIDS患者中,当临床诊断存在困难,或抗弓形虫治疗14 d疗效不佳时,需尽早行脑活检进行确诊,以免延误诊治影响预后[7].然而该操作过程存在一定风险,术后易出现并发症,严重者可威胁生命,故多数AIDS/TE患者仅为临床诊断.
本病需与以下疾病相鉴别:
-
急性或亚急性起病,可通过流行病史或既往病史与TE进行鉴别.主要症状与TE类似,如发热、头痛、呕吐等,可伴有颅内压增高、脑膜刺激征及其他神经功能缺损的症状和体征.结核性脑膜炎患者脑脊液外观呈黄色,静置后可有薄膜形成,淋巴细胞显著升高,但一般不超过500×106/L,蛋白质明显升高,通常为1~2 g/L,糖和氯化物降低.脑脊液抗酸染色可鉴定结核杆菌,培养阳性是诊断结核性感染的金标准,但阳性率较低.肺部或肺外发现结核病灶有助于结核性脑膜炎诊断.若不能获得病原学证据或临床诊断不易确定,可进行试验性抗病原体治疗,并根据治疗应答情况进行鉴别[33].
-
患者临床表现同TE相似,可有头痛、发热、呕吐等,常伴有颅内压增高,可出现脑脊液淋巴细胞增多、蛋白质含量增高和葡萄糖定量降低.墨汁染色镜检发现隐球菌或脑脊液隐球菌培养阳性即可确诊[33],血液或脑脊液隐球菌抗原阳性也有助于鉴别诊断.
-
AIDS患者病毒性脑炎以CMV脑炎较为多见,通常表现为痴呆、嗜睡、精神错乱、颅神经麻痹、共济失调或眼球震颤等,脑脊液CMV DNA检测可协助诊断[37],脑组织活检发现CMV包涵体为金标准[11].头颅影像学可见脑室周围增强伴或不伴脑室肿大.
-
该疾病是一种病毒感染性脑病,与JC病毒、BK病毒等多种人类多瘤病毒相关[38],常以精神症状为首发表现[39],可通过PCR法检测脑脊液中多瘤病毒DNA进行确诊[40].
-
患者常有不洁性生活史,伴或不伴全身梅毒,有相应神经损害的临床表现.血清和脑脊液梅毒试验呈阳性,脑脊液生化常规常见单核细胞数增高,达100×106/L~300×106/L,蛋白质增高,达0.4 g/L~2 g/L.头颅影像学可见脑萎缩、脑室扩大等征象[33].
-
患者可能存在脑膜炎症状及体征,头颅MRI多见颅内占位性病变,必要时可行脑组织活检确诊.临床上可通过SPECT检测对颅内肿瘤和TE进行鉴别诊断[35].
6.1. 结核性脑膜炎
6.2. 隐球菌性脑膜脑炎
6.3. 巨细胞病毒性(CMV)脑炎
6.4. 进行性多灶性白质脑病(progressive multifocal leucoencephalopathy,PML)
6.5. 神经梅毒
6.6. 颅内肿瘤
-
对于大多数患者而言,TE临床诊断后即可开始治疗,包括抗弓形虫治疗、支持治疗及ART.
-
推荐剂量与疗程:SMZ-TMP 1.44 g/次,口服,3次/d,或SMZ 25 mg/kg和TMP 5 mg/kg,口服,2次/d,联合克林霉素600 mg/次,静脉注射,每6 h 1次,或阿奇霉素0.5 g/d,静脉注射,1次/d,疗程至少6周.若诊断较为明确而治疗6周后影像学表现改善不明显,可适当延长疗程.
国内外指南[11,41]均将该方案列为推荐的替代方案,而首选方案中乙胺嘧啶(pyrimethamine)和磺胺嘧啶(sulfadiazine,SD)在我国可及性非常有限.实际上,临床研究[2,42]表明该替代方案的疗效和安全性与乙胺嘧啶—磺胺嘧啶联合方案(即P-S方案)无差异.在国内一项研究中[34],57例AIDS/TE患者均予以SMZ-TMP联合阿奇霉素进行治疗,84.2%(48/57)临床转归良好,15.8%(9/57)病情恶化死亡. Wei等[42]一项针对弓形虫病的荟萃分析显示,SMZ-TMP与P-S方案的治愈率分别为59.9%和49.8%,且两组间无统计学差异. Hernandez等[2]发现SMZ-TMP的临床应答率与P-S方案相似(RR 0.97;95% CI 0.78~1.21),不良反应(皮疹)发生率亦无明显统计学差异(RR 0.17;95% CI 0.02~1.29).
磺胺甲噁唑(SMZ)为磺胺类化学合成药,甲氧苄啶(TMP)为磺胺增敏剂,二者合用可阻断弓形虫的叶酸代谢,从而发挥抗菌作用. SMZ-TMP具有过敏、白细胞减少症、中性粒细胞减少症、肝肾功能损害等不良反应,若患者对SMZ-TMP过敏,可通过脱敏疗法逐渐加至治疗剂量.克林霉素和阿奇霉素作用机制相似,均与核糖体50S亚基结合,阻止肽链延长,从而抑制弓形虫细胞的蛋白质合成.克林霉素和阿奇霉素具有胃肠道反应、白细胞减少症、肝肾功能损害等不良反应.
-
推荐剂量与疗程:联磺甲氧苄啶片1.44 g/次,口服,每8 h 1次;克林霉素600 mg/次,静脉注射,每6 h 1次或阿奇霉素0.5 g/d,静脉注射,1次/d;疗程至少6周.若诊断较为明确而治疗6周后影像学表现改善不明显,可适当延长疗程.
联磺甲氧苄啶片为SMZ,SD和TMP的复方制剂,其中SMZ和SD均能与对氨基苯甲酸竞争二氢叶酸合成酶,使弓形虫不能合成二氢叶酸,TMP则通过抑制弓形虫的二氢叶酸还原酶,阻碍二氢叶酸还原成四氢叶酸.该药主要不良反应为过敏、中性粒细胞减少症、血小板减少症、溶血性贫血、肝肾功能损害、胃肠道反应.
-
根据患者体质量,选择不同剂量治疗[11].体质量>60 kg者:乙胺嘧啶,负荷剂量200 mg,此后75 mg/d,口服,2次/d,联合磺胺嘧啶1.5 g/次,口服,每6 h 1次,疗程至少6周;体质量≤60 kg者:乙胺嘧啶,负荷剂量200 mg,此后50 mg/d,口服,2次/d,联合磺胺嘧啶1.0 g/次,口服,每6 h 1次,疗程至少6周.该方案虽为国内外指南[11,41]推荐的首选方案,然而由于药物可及性,现我国临床较少使用.此两种药物均为弓形虫叶酸拮抗剂,对增殖期弓形虫有抑制作用,且乙胺嘧啶还可进入脑实质发挥作用.该方案存在一定复发率,但广泛应用ART后,基于乙胺嘧啶治疗TE的复发率呈下降趋势. Connollym等[43]纳入了基于乙胺嘧啶治疗TE的1 596例患者,发现ART广泛开展前复发率约为20%,ART广泛开展后的复发率约为10%.
大剂量应用乙胺嘧啶时,易出现叶酸缺乏现象,主要影响细胞生长繁殖特别迅速的组织,如骨髓、消化道粘膜,致造血机能异常,引起消化道症状.因此,该方案需联合甲酰四氢叶酸使用,降低乙胺嘧啶相关血液毒性发生率[11].
-
当患者对磺胺类药物和乙胺嘧啶等不耐受时可选用此方案.一项日本的病例报告中,一位57岁的男性AIDS/TE患者,先后予以SMZ-TMP、P-S方案、阿托伐醌等均不可耐受,后于第12天更改方案为克林霉素联合阿奇霉素,第1,3,8月进行影像学复查显示病灶明显减少.推荐剂量:克林霉素(2 400 mg/d)联合阿奇霉素(1 200 mg/d),疗程至少6周[44].
-
在一项临床研究中[42],乙胺嘧啶联合克林霉素的临床治愈率可达47.6%,与P-S方案无明显差异.近期一项研究显示,单用SMZ-TMP同样有效且安全[45].该研究显示[45],抗弓形虫治疗2周的临床和影像学应答率为85%(39/46),仅2例患者因不良反应而停药.一项病例报道显示[21],单独使用散装粉配制成的乙胺嘧啶口服悬液也可成功治疗TE.
-
一般AIDS/TE患者不建议常规予以糖皮质激素进行治疗,激素辅助治疗应仅用于存在局部脑病变或水肿相关性占位效应者,例如有放射影像学中线偏移证据的患者. Arens等[46]回顾性分析了43例AIDS/TE患者,发现接受糖皮质激素治疗组(26例)6人死亡,而未接受激素治疗组(17例)无人死亡,笔者认为糖皮质激素治疗增加了AIDS/TE的死亡风险.此外,糖皮质激素能降低环形强化的强度和周围水肿量,导致抗弓形虫疗效很难评估,也易造成非TE患者延误治疗,影响预后.
-
癫痫发作者应给予抗癫痫治疗,但不应常规预防性使用抗癫痫药物[11],而且需注意抗癫痫药物与ART药物间的相互作用.
-
针对TE伴高颅压的患者,常使用甘露醇等脱水剂进行对症治疗.
-
目前,对于AIDS/TE患者ART启动时机的推荐多基于临床经验,一般认为可在抗弓形虫治疗2~3周后启动[11],但由于缺乏高质量研究证据支持而存有争议.就AIDS相关机会性感染而言,早启动ART可能会增加免疫重建炎症综合症(immune reconstitution inflammatory syndrome,IRIS)的发生风险.然而一项针对282例机会性感染的随机对照研究显示(其中约5%为AIDS/TE),早启动ART组(抗机会性感染治疗后中位时间12 d)比延迟启动ART组(抗机会性感染治疗后中位时间45 d)进展为艾滋病期或死亡的发生率显著降低[47]. ART药物与抗弓形虫药物之间可能存在相互作用,如SMZ-TMP与齐多夫定、拉米夫定、恩曲他滨、捷扶康、达可辉、可西他夫;克林霉素与捷扶康;磺胺嘧啶与齐多夫定、拉米夫定、替诺福韦、依非韦伦、克力芝、恩曲他滨、依曲韦林、阿扎那韦、达芦那韦、捷扶康、达可辉、可西他夫;乙胺嘧啶与齐多夫定、拉米夫定、恩曲他滨、捷扶康、达可辉、可西他夫.上述药物联用时应密切监测患者情况.
7.1. 抗弓形虫方案
7.1.1. 磺胺甲噁唑—甲氧苄啶(SMZ-TMP)联合克林霉素或阿奇霉素
7.1.2. 联磺甲氧苄啶片联合克林霉素或阿奇霉素
7.1.3. P-S方案
7.1.4. 克林霉素联合阿奇霉素
7.1.5. 其他方案
7.2. 辅助性治疗
7.2.1. 糖皮质激素
7.2.2. 抗癫痫药
7.2.3. 降颅压
7.3. ART
-
部分AIDS/TE患者启动ART后会发生TE-IRIS.矛盾型TE-IRIS指在ART前即存在TE,且开始抗弓形虫治疗后症状好转,但在启动ART后出现临床恶化,并可伴有全身炎性症状.暴露型TE-IRIS指在开始ART前未发现的TE在ART后出现相关症状,也可能是原有的隐匿感染活化所致[48-50]. TE-IRIS一般在ART后105 d左右出现相关症状[51],临床以矛盾型为主,发病率约为3.5%,暴露型发病率约为0.4%[48].
TE-IRIS通常表现为意识混乱、头痛、偏瘫、癫痫等,影像学上呈典型的环形强化.有研究显示,IRIS诊断时或开始ART时的CD4和HIV RNA计数在矛盾型IRIS组和未发生IRIS组间无明显差异[48].笔者据此认为,不同于其他机会性感染,CD4和HIV RNA计数可能并非TE-IRIS发生的危险因素[48].目前,关于TE-IRIS尚无统一诊断标准,诊断要点包括:①启动ART后患者HIV RNA下降,CD4+T淋巴细胞计数迅速增加;②启动ART后患者出现TE相关临床表现,或原本已改善的临床症状转而恶化;③排除其他原因导致的病情恶化,如新发感染、耐药、药物毒副作用及复发等.
TE-IRIS的治疗需根据患者实际情况,采取ART、抗弓形虫治疗及抗炎对症处理相结合的方式.一般情况下不考虑停止ART,部分患者病情在继续ART后可自行缓解.矛盾型IRIS推荐继续原有剂量抗弓形虫治疗.暴露型TE-IRIS由于ART前未发现合并TE,因此未进行或未规范抗弓形虫治疗,出现TE-IRIS后应立即进行规范的抗弓形虫治疗.研究表明,糖皮质激素有助于恢复血脑屏障功能,减少T细胞活化,防止炎性细胞内流,为TE-IRIS的主要抗炎疗法.基于临床和结核相关IRIS的治疗经验,糖皮质激素推荐剂量与疗程为:①轻度IRIS,建议使用1 mg/(kg·d)泼尼松(或地塞米松当量),1~2周;②中度IRIS,建议先使用1.5 mg/(kg·d)泼尼松(或地塞米松当量)2周,再使用0.75 mg/(kg·d)泼尼松(或地塞米松当量)2周,随后逐渐减量;③重度IRIS(严重水肿或即将发生脑疝),建议使用1 g强的松3~5 d,随后逐渐减量[1].
-
对CD4<200个/μL,且弓形虫IgG抗体阳性的AIDS患者应给予一级预防用药,直至CD4+T淋巴细胞计数增加到>200个/μL并持续3~6个月[1].首选SMZ-TMP,2片/次,1次/d.若患者不能耐受SMZ-TMP,可予以乙胺嘧啶、氨苯砜、阿托伐醌等进行替代.一项回顾性分析结果显示,预防性使用SMZ-TMP者发生TE的风险为0~2.4%,小于使用乙胺嘧啶的0~11%[43].
-
目前,所有抗弓形虫药物均仅对弓形虫速殖子有效,对包囊无效[1],因此在治疗诱导期结束后TE复发率较高[43],需进行二级预防.推荐药物与治疗期相同,但会降低每种药物剂量以增加患者耐受性[7].由于药物可及性等因素,我国患者首选SMZ-TMP,2片/次,1次/d,直至CD4+T淋巴细胞计数增加到>200个/μL并持续≥6个月.一旦CD4+T淋巴细胞计数下降到<200个/μL,需重新开始预防用药.研究表明,相较于间歇性预防治疗,持续预防的患者复发风险更低[43].



 下载:
下载: