-
开放科学(资源服务)标志码(OSID):

-
单核细胞增生性李斯特菌(Listeria monocytogenes,LM)简称单增李斯特菌,为兼性厌氧侵袭性胞内菌,为重要的食源性人畜共患病原菌. LM的致病性与毒力基因密切相关,主要由两个毒力岛群构成:毒力岛1主要与胞内感染有关,由6个主要的毒力基因(prfA-plcA-hly-mpl-actA-plcB)编码组成;毒力岛2主要负责黏附与侵袭,由内化素家族(in1A,in1B,in1C到inlH)组成[1]. 病原菌在in1A和in1B的帮助下可穿越胎盘屏障、血脑屏障和肠道屏障[2],并在各毒力因子的协调下引发流产、早产、胎儿发育障碍以及脑膜炎、胃肠炎和败血症等临床症状. 虽然LM感染引起的疾病发生率不高,但据世界卫生组织报道李斯特菌病死亡率却高达23.6%[3]. 目前,临床上主要应用抗生素对李斯特菌病进行治疗,但抗生素的广泛应用和不合理使用,使得LM的耐药现象愈发严重,甚至出现多重耐药菌株[4]. LM的致病性也与血清型和基因型的差异密切相关. LM的血清型共分为13种,其中1/2a,1/2b,1/2c和4b血清型最易引起人类感染李斯特菌病. MLST分型主要有16种,包括ST9,ST1,ST2,ST3,ST5,ST87,ST121,ST8,ST7,ST59,ST4,ST6,ST122,ST155,ST101和ST199[5-6]. 其中,ST5,ST8,ST9和ST87既是引起李斯特菌病暴发的常见ST型,又是我国耐药菌株的常见ST型[7-8]. 致病性血清型、MLST分型以及耐药性之间是否具有一定的联系,还需进一步的研究. 已有研究发现LM的进化主要是菌株不断突变的结果[9],因此对发生在食品链中LM进行生物学分型检测,并根据分离株的耐药谱、血清型和基因型的分布情况绘制进化树,能有效对污染源进行追踪,从根源上防止单增李斯特菌病的暴发,对保护人类身体健康具有重要的现实意义. 本研究关于重庆地区超市鸡肉中LM的污染情况调查、耐药表型分析、血清型分型和MLST分子分型方法的应用将为监测程序的建立提供一定的数据支撑.
全文HTML
-
2018年6月至7月之间,24株来自重庆地区超市鸡肉中分离到的LM,均根据食品安全国家标准(GB 4789.30-2010)中《食品微生物学检验—单核细胞增生李斯特氏菌检验》标准方法检测确认. 标准菌株是单增李斯特菌C53005,大肠杆菌ATCC25922,金黄色葡萄球菌ATCC25923,沙门氏菌ATCC50115,菌株购自中国医学细菌保藏管理中心.
-
2×Taq PCR MasterMix(含染料),100 bp DNA Ladder,ddH2O购自北京Tiangen公司;单增李斯特菌分离所需各种肉汤和试剂,均购自北京路桥技术有限公司;19种抗生素药敏纸片购自赛默飞世尔科技(中国)有限公司;10对毒力基因引物由重庆奥哲公司合成,引物信息见表 1.
-
煮沸法提取菌液DNA后进行PCR扩增,PCR的反应条件:① 25 μL反应体系:2×Taq PCR MasterMix(含染料)10 μL,正、反向引物(5 μmol/L)各1 μL,DNA模板2 μL,加ddH2O至25 μL;②反应程序:95 ℃预变性5 min;94 ℃变性50 s;退火(表 1);72 ℃延伸50 s (30个循环);72 ℃终延伸10 min.
-
根据临床实验室标准研究所(Clinical and Laboratory Standards Institute,CLSI)推荐的单增李斯特菌药物敏感性试验执行标准,结合临床用药选择青霉素(P,10 units)、苯唑西林(OX,30 μg)、氨苄西林(AMP,10 μg)、头孢噻吩(KF,30 μg)、头孢哌酮(CFP,75 μg)、头孢噻肟(CTX,30 μg)、红霉素(E,15 μg)、链霉素(S,10 μg)、庆大霉素(CN,10 μg)、万古霉素(VA,30 μg)、多粘菌素B (PB,300 units)、四环素(TE,30 μg)、多西环素(DO,30 μg)、氯霉素(C,30 μg)、环丙沙星(CIP,5 μg)、阿米卡星(AK,30 μg)、磺胺/甲氧苄胺嘧啶(SXT,25 μg)、利福平(RD,5 μg)及呋喃妥因(F,300 μg)共19种抗生素,采用K-B纸片扩散法进行药物敏感性试验. 同时用大肠杆菌(ATCC25922)、金黄色葡萄球菌(ATCC25923)和沙门氏菌(ATCC50115)作质量控制,对每种抗菌药物敏感、中敏和耐药的结果判断参照CLSI标准(2013版)中葡萄球菌属标准执行.
-
采用M Doumith介绍的多重PCR法对LM的血清型进行检测[13].
-
采用法国巴斯德数据库提供的用于单增李斯特菌的MLST分型方法[14]. 扩增产物先经1.2%的琼脂糖凝胶电泳验证,之后送往上海生工生物技术服务公司纯化并进行测序,测序结果利用DNAStar软件进行拼接,剪取成对应管家基因的长度,提交MLST数据库得到7个管家基因的等位基因编码(http://www.pasteur.fr/recherche/genopole/PF8/mlst/Lmono.html),然后将每株菌7个管家基因等位基因编码按相应顺序排列,提交数据库后便可获得ST型.
1.1. 材料
1.1.1. 菌株
1.1.2. 试剂与仪器
1.2. 方法
1.2.1. 毒力基因的检测
1.2.2. 药物敏感性试验
1.2.3. 血清学分型
1.2.4. MLST分型
-
2018年6月至7月之间,从重庆江北区、北碚区、江津区、南岸区、合川区等5个区超市的鸡肉中采集108份样品,共分离出24株LM,分离率为22.2%.
-
利用PCR法对24株LM进行毒力基因检测,结果23株分离株均检测出10个毒力基因,仅1株在inlB基因上出现了基因缺失(表 2),菌株携带毒力基因普遍,暗示超市鸡肉中存在潜在威胁,需引起重视.
-
药物敏感性试验结果表明,分离株对苯唑西林(96.0%)、头孢噻肟(41.7%)和多粘菌素B(37.5%)的耐药率较高,而对其余药物耐药率低,其中对头孢噻吩、环丙沙星、阿米卡星和呋喃妥因完全敏感. 24株LM中耐2种以上的抗生素有7株,多重耐药率为29.2%,并发现1株对11种抗生素(AMP-OX-P-E-S-CN-VA-TE-C-SXT-RD)耐药的超级耐药菌,具体结果见表 3.
-
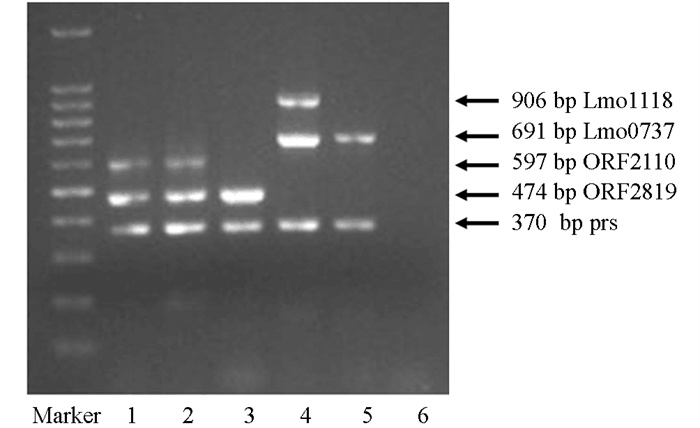
血清学分型结果显示,24株LM共检出4种血清型,分别为1/2a,1/2b,1/2c和4b型(图 1). 1/2b型和4b型所占比例分别为25.0%和16.6%,属于谱系I,共10株;1/2a型和1/2c型所占比例均为29.2%,属于谱系II,共14株. 多重PCR电泳图(图 2)显示:泳道1为单增李斯特菌阳性对照C53005 4b型(4b,4d,4e);泳道2为4b型于597 bp,474 bp,370 bp处有扩增片段,属于单增李斯特菌血清组4b,4d,4e;泳道3为1/2b型于474 bp,370 bp处有扩增片段,属于单增李斯特菌血清组1/2b,3b,7;泳道4为1/2c型于906 bp,691 bp,370 bp处有扩增片段,属于单增李斯特菌血清组1/2c,3c;泳道5为1/2a型于691 bp,370 bp处有扩增片段,属于单增李斯特菌血清组1/2a,3a;泳道6为阴性对照.
-
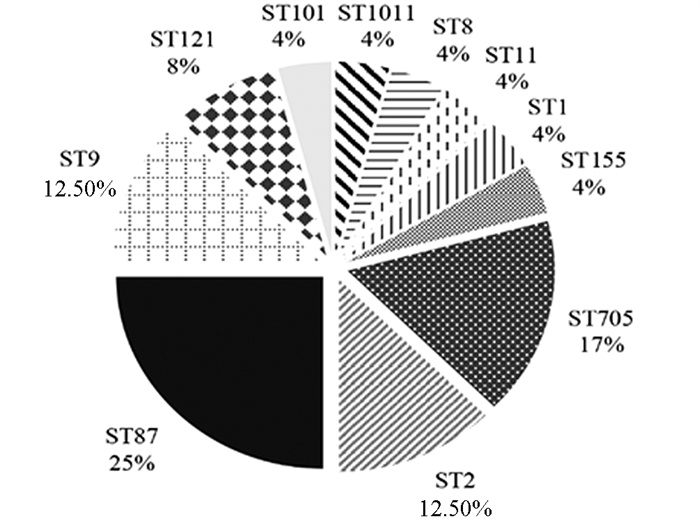
MLST分型共鉴定出11个序列型(Sequence type,ST),其中易引起单增李斯特菌病的常见ST型(ST87,ST9,ST2)菌株占50%(12/24),并发现1个新的ST型,即ST1011,目前已提交巴斯德研究所MLST数据库. ST87分布最为广泛,其次是ST705,ST9和ST2,具体分布见图 3.
-
进化树结果显示:血清型相同的菌株,其亲缘关系较近. 首先,血清型和ST型之间对应关系紧密,如ST87与1/2b型单增李斯特菌对应,ST2与4b型LM对应. 此外,部分ST型可对应于同一血清型,例如ST705和ST9对应于1/2c型LM;ST155,ST11,ST101,ST121和ST8都对应于1/2a型LM. 其次,耐受苯唑西林和同时耐受苯唑西林—头孢噻肟的单增李斯特菌MLST分型有明显集中趋势,主要集中在ST705,ST87和ST2上. 江北区(JB)、江津区(JJ)、南岸区(NA)、合川区(HC)分离到的菌株同源性较高,大多数耐受苯唑西林,且血清型均为谱系II;而北碚区(BB)分离到的菌株大多耐受苯唑西林—头孢噻肟,且血清型均为谱系I,具体分布见图 4.
2.1. 重庆地区鸡肉中LM的分离情况
2.2. 24株LM分离株毒力基因的检测结果
2.3. 24株LM分离株药物敏感性试验结果
2.4. 24株LM分离株血清学分型结果
2.5. 24株LM分离株MLST基因分型结果
2.6. 24株LM分离株耐药谱与血清型、ST型UPGMA tree分析结果
-
单增李斯特菌广泛存在于自然界中,食入被LM污染的食品是单增李斯特菌病暴发的主要原因. 在对国内已报道的肉品中LM污染情况分析发现,虽然2010年后单增李斯特菌总体分离率较此前有所下降,但肉品中LM的污染率仍然处在较高水平[15]. 且在各类肉品检测结果中,鸡肉中LM污染率显著高于其他各类肉品[16]. 因此,鉴定和监测超市鸡肉中LM的污染情况,可以确定适当的防控措施,最大限度地减少鸡肉中LM的存在,这对于公共卫生安全极为重要. 在本研究中,LM的分离率为22.2%(24/108),该结果低于蒋兴祥等[17]的报道(53.3%,16/30),高于乌日娜等[18]的报道(8.33%,10/120),而与吴晓芳等[19]的报道基本一致(25%,10/40).
LM的血清型共分为13种. 其中,血清型1/2a,1/2b,1/2c和4b最易引起人类感染李斯特菌病,也是中国食品中分离LM菌株的优势血清型[20]. 有研究显示,超过95%的人类李斯特菌病是由血清型4b,1/2a和1/2b造成的[21]. 本试验中24株LM大多为1/2a,1/2b和1/2c型,另有4株致病性较强的4b型菌株,该结果与Sosnowski等[22]报道的基本一致. 虽然鸡肉中致病性LM血清型污染率很高,但目前我国李斯特菌病报道的较少,可能与我国对该菌的监测系统和检测水平不高有关.
由于血清型对LM的分辨能力过低,因此,它不能对该菌进行准确溯源. 而多位点序列分型(MLST)方法,是在多位点酶切电泳技术的基础上为研究菌群基因结构而设计的一种高分辨率分型技术. 据文献报道,ST5,ST8,ST9和ST87是引起食源性LM暴发的主要ST型,常造成人类感染单增李斯特菌病[7-8]. 在本次试验中,24株LM鉴定出11个ST型,其中易引起单增李斯特菌病的常见ST型(ST87,ST9,ST2)菌株占50%(12/24),并发现1个新的ST型,即ST1011. 进化树分析结果显示分离株血清型相同的菌株,亲缘关系较近. 首先对比MLST与血清型发现,LM血清型和ST型之间都有着十分紧密的对应关系,并且大部分ST型与血清型存在一一对应的关系,如ST87与1/2b型对应,ST2与4b型对应;但也有2种或以上ST型可对应于同一血清型,例如ST705和ST9对应于1/2c型,ST155,ST11,ST101,ST121和ST8都对应于1/2a型. 其次,耐受苯唑西林和同时耐受苯唑西林—头孢噻肟的单增李斯特菌MLST分型有明显集中趋势,主要集中在ST705,ST87和ST2上;而Wu等[14]的结果与该试验不一致,它主要集中在ST8,ST1和ST87上. MLST分型技术可以较好地用于肉品中单增李斯特菌污染的分子溯源,但本研究仅从鸡肉中分离到LM并做MLST分型分析其危害性,未能对鸡肉中LM污染的来源进行深入研究. 后续可从超市环境中和鸡的屠宰加工车间采样分离LM,与鸡肉中分离的LM进行分子分型研究,找出鸡肉中LM污染的关键风险点,为进一步降低鸡肉中LM的污染提供技术支持.
近年来,食品中分离出的LM对抗生素的耐药现象愈加严重,这无疑给食品安全带来了潜在性威胁. 抗生素的广泛使用会导致耐药菌株的产生,刀丽梅等[23]和周瑶琴等[24]发现鸡源和牛源分离株中耐药菌占大部分,且表现为多重耐药现象. 本试验中LM主要耐受苯唑西林、头孢噻肟和多粘菌素B;对四环素、红霉素、氯霉素、环丙沙星敏感性较高,这与闫韶飞等[25]和赵悦等[26]的报道恰恰相反,与Chen等[27]的报道结果不完全一致,而与王红等[28]报道的结果较一致. 另外,在本试验中部分菌株已对一线药物氨苄西林和青霉素产生了耐药性. 24株分离株中耐2种以上抗生素的有7株,多重耐药率为29.2%,该结果与Sosnowski等[22]的报道基本一致(27.4%,40/146),而高于Wieczorek等[29]的报道(3.5%,2/57). 值得注意的是,这些耐药菌株大多分布在我国常见LM的ST型(ST87,ST705,ST9和ST2)中. 其中,在ST9型菌株中发现1株对11种抗生素耐药的超级耐药菌,这与之前研究报道的ST9型菌株多重耐药现象较严重相符[30]. 应对该超级耐药菌株做进一步研究,这将有助于阐明ST9型菌株与多重耐药的关系. 本研究还发现,分离株血清型相同的菌株,其耐药株ST型和引起单增李斯特菌病常见ST型具有相近的流行趋势,均主要分布在ST87,ST9,ST705型中,这三者之间是否具有一定的遗传进化关系,还需要做进一步研究.
目前,关于LM在鸡肉中致病性的研究较少,毒力基因编码的毒力因子是LM致病的分子基础. 通过检测毒力基因,可以了解这些基因在重庆LM中的分布. LM感染宿主的每一步均有特定的毒力基因编码的毒力因子的精确调控. prfA是毒力岛上一个转录调控基因,对岛上其他基因的表达进行调控,它的缺失将直接导致LM毒力的下降[31]. 因此,LM毒力基因携带率越高,其致病性也将越强,反之则导致致病性的消失或下降. 本试验24株分离株中,23株均检测出10个毒力基因,仅1株在inlB基因上出现基因缺失. 这与宫照龙等[11]和廖兴广等[32]的研究结果基本一致. 但有文献报道,LM为了更好地适应环境,其毒力基因在自然条件下都存在不同程度的缺失[10, 33]. 因此,我们在对LM毒力基因建立检测时,要考虑到毒力基因缺失导致检测结果假阳性的问题,从而更好地防控李斯特菌病的暴发.




 下载:
下载: