-
开放科学(资源服务)标志码(OSID):

-
据《联合国世界水发展报告》指出,地下水约占地球上液态淡水储量的99%,是地球上最重要的可利用淡水资源[1]. 岩溶地下水作为地下水资源的重要组成,为中国西南岩溶区近1亿人提供了生产生活用水[2-3]. 岩溶区具有独特的岩溶地质构造和密集的人类活动,导致其地下水硝酸盐污染十分普遍[4],许多地区地下水中的硝酸盐污染指数已超过2022年最新的国家生活饮用水中N的最低标准10 mg/L[5]. 人若长期摄入高浓度硝酸盐,可能引起婴儿高铁血红蛋白血症和成人胃癌等疾病[6]. 水的硝酸盐浓度过高还会导致水生生物生存环境恶化,严重危害生态安全[7]. 岩溶水文系统具有岩溶地下水系统的二元性、各向异性、高度联系性、敏感性和脆弱性等独特的水文地质特征,表现为地表水和地下水的转换过程迅速[8],对环境变化的响应十分敏感[9],导致岩溶地下水系统的污染问题更为严重和复杂. 这种复杂性表现在硝酸盐的转化与来源中,引起了许多学者的关注[10-11]. 在不同人类活动条件下,地下水硝酸盐转化与来源在时空上发生了复杂的生物地球化学过程分异[12]. 目前对该种分异的影响机制尚不清楚,需要对硝酸盐来源及转化的过程和结果详细分析,才能精确识别硝酸盐转化与来源,为不同岩溶区硝酸盐排放的政策制定和治理提供参考.
不同来源的硝酸盐有不同的氮氧同位素值(δ15N-nitrate,δ18O-nitrate),这为利用同位素方法识别硝酸盐转化与来源提供了可能性[13]. 氮氧同位素受硝化作用、反硝化作用和异化还原为氨等微生物的影响,可能引起同位素分馏,改变氮氧同位素组成. 例如,水中较轻的14N,16O可能被微生物利用而分馏,较重的15N,18O留在水中. 这就为利用硝酸盐氮氧同位素来反演生物地球化学过程提供了可能. 近些年,贝叶斯同位素混合模型成为定量解析硝酸盐来源的高效工具,能精确地识别不同时空和人类活动条件下地下水硝酸盐的来源[14].
水房泉和青木关地下河流域是我国西南地区典型的岩溶地下河流域,自然条件和人类活动均存在较大差异[15-19]. 水房泉流域位于自然保护区内,以旅游活动为主;青木关流域位于城镇郊区,以农业活动为主. 基于这些差异,探究硝酸盐转化与来源,对于揭示岩溶地下河硝酸盐污染特征及其原因具有重要意义.
全文HTML
-
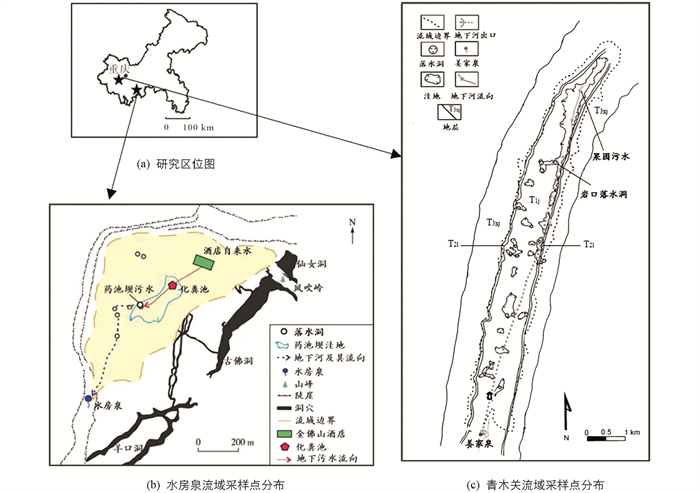
水房泉岩溶地下河流域地理坐标为:29°01′54″-29°02′06″N,107°10′24″-107°11′47″E,位于重庆市南川区南部(图 1a,1b),金佛山山顶的平缓台地上,流域海拔约为2 100 m. 流域具有温带湿润气候的特征[20],多年平均气温低于8.3 ℃,最高温度仅有26 ℃,年均降水量1 395.5 mm,主要集中在5-10月,约占常年降水量的83%[21]. 流域内洼地、落水洞等岩溶地貌类型分布密集[22],利于地表水下渗. 地质构造呈宽缓向斜构造,无较大裂隙和断层发育,向斜构造具备很好的储水条件[23]. 在地层岩性上,流域位于二叠统灰岩与煤系地层之间,煤系地层形成隔水层[24],不利于深层地下水下渗. 金佛山山顶人类活动以旅游业为主,没有工农业活动;6-9月是金佛山的最佳避暑时间,是金佛山旅游旺季之一[25]. 调查结果显示,2021年,水房泉流域土地利用类型有:林地、草地、不透水面、裸地和水体,分别占比83.1%,10.4%,3.5%,1.7%和1.2%(表 1). 土壤类型以为山地黄壤为主,土层松软,地表水下渗速度较快. 大气沉降和土壤有机氮可能是主要的硝酸盐自然来源[26-27].
水房泉(29°01′42″N,107°10′56″E)是水房泉地下河的主要地下水出口(图 1b),多年均流量为1.26×105~1.58×105 m3/a[28]. 该流域主要污水来源于地下河上游的某酒店,酒店到水房泉直线距离约1 km[29],污水经过多级化粪池沉淀,水质明显变清,进入地下水系统[30]. 同时污水滞留时间很短,仅为16.9 h,到达水房泉出口平均需要90.3 h[31],地下水循环周期很短,特别是旅游旺季期间污染问题比较严重.
综上,推测水房泉流域的硝酸盐主要来源于土壤中的有机氮、酒店污水以及大气沉降的氮素等.
青木关岩溶地下河流域地理坐标为:29°46′17″-29°40′58″N,106°19′38″-106°17′30″E,位于重庆市北碚区、沙坪坝区与璧山区三区交界地带(图 1c). 流域为典型的岩溶槽谷区,海拔为310~705 m[32]. 流域属于亚热带季风气候,年均气温约18.5 ℃,年均降水量约1 250 mm,集中在5-10月. 流域面积约13.4 km2,被一条东北—西南走向地下河贯穿,长度约7.4 km[32]. 流域内普遍为洼地地貌,多岩溶湖发育[33-34]. 流域为“一山二岭一槽”式的典型岩溶槽谷景观[35],位于青木关背斜轴部,下三叠统的嘉陵江组碳酸盐岩地层,岩性主要为灰色块状灰岩及白云质灰岩等. 调查结果显示,2017年,青木关流域土地利用类型有:林地、耕地、不透水面、园地、裸地、水体、草地,分别占比78.15%,7.5%,5.4%,4.7%,1.7%,1.6%,1.0%(表 1). 流域发育地带性黄壤和非地带性石灰土,亚热带常绿阔叶林和旱生喜钙型灌木为主要植被类型[32].
姜家泉(29°41′00″N,106°17′30″E)是青木关地下河最主要的出口[33]. 姜家泉流量季节变化很大,最大流量4 360 L/s[36],枯水季节干涸断流. 泉口位于青木关镇关口村一农户家后院内,农户修建水渠引水流入青木溪,最终进入嘉陵江. 青木关地下河系统裂隙构造分布广泛,地下河相对高差大,水流速度快,地下水含氧量高[33].
综上,推测青木关地下河主要硝酸盐来源为化肥、土壤有机氮、生活污水、粪肥污水、养殖业产生的污水以及大气沉降的氮素等.
-
根据两条地下河补给、径流和排泄的关系,在青木关地下河流域确定3个采样点:分别是上游果园污水、中游岩口落水洞和下游姜家泉出口(图 1c),而水房泉地下河流域4个点:源头酒店自来水、上游化粪池、中游药池坝污水和下游水房泉出口(图 1b). 在2021年5月至2021年10月期间,每月采集5个样品. 分别为:① 330 mL水样用于测试主要阴离子(NO3-,SO42-和Cl-)质量浓度;② 330 mL样品用于测试NH4+质量浓度;③ 50 mL水样于现场加入3~5滴1∶1 HNO3-,使水样酸化至pH值<2,用于测试阳离子(K+,Na+,Mg2+)质量浓度;④ 50 mL样品用于测试δ15N-nitrate和δ18O-nitrate值. ⑤ 2 mL样品用于测试水的氢氧同位素(δ2H和δ18O值). 除水氢氧同位素样品使用顶空玻璃瓶收集,其余样品均使用聚乙烯瓶收集,均使用0.22 μm的混合纤维素膜过滤. 除用于测试δ15N-nitrate和δ18O-nitrate值的样品需在-20 ℃冰箱冷冻保存,其余样品均放4 ℃冰箱冷藏.
-
使用Multi3630便携式多参数水质仪(WTW,Germany)测定水温、pH值、电导率、溶解氧4项指标,测量精度分别为0.1 ℃,0.01,1 μS/cm,0.01 mg/L;Ca2+和HCO3-质量浓度使用硬度、碱度试剂盒(Merck,Germany),采用原位滴定法测定,测量精度分别为1 mg/L和0.1 mg/L. 阴离子质量浓度使用离子色谱仪(AQUION,Thermo Fisher Scientific,USA)进行测试,阳离子质量浓度使用电感耦合等离子体发射光谱仪(ICP-OES,Perkin Elmer Optima2100,USA)进行测试,测量精度均为0.01 mg/L. NH4+质量浓度使用HQ40d多参数水质仪(Hach,USA)测定,测量精度为0.01 mg/L. 所有水化学指标检测均在西南大学地球化学和同位素实验室完成. δ15N-nitrate值和δ18O-nitrate值是基于反硝化测定法,使用痕量气体同位素质谱连用仪(Isoprime,UK)进行测量,N同位素以标准大气中的N2为参照,使用两点校正方程对测定的气体校正,检测精度为0.01‰,检测在中国农业科学院农业环境稳定同位素实验室完成. 水的δ2H和δ18O值使用同位素分析仪(L2130-i,Picarro,USA)测量,H,O同位素以维也纳标准平均海水(V-SMOW)为参照,精度分别为±0.1‰和±0.025‰,检测在吉林大学教育部地下水资源与环境重点实验室完成.
-
阴阳离子平衡检验数据均小于或等于5%,公式为:
式中:E表示相对误差率(%);Nc和No分别代表阴阳离子毫克当量浓度(meq/L).
-
MixSIAR模型是由Parnell等[37]开发和应用的SIAR更新而来,增加了误差结构和收敛诊断,提高了不同来源对混合物贡献率的准确性[38]. 明晓星[39]将MixSAIR模型运用到硝酸盐来源定量研究,该模型成为硝酸盐来源定量研究的最佳工具之一. 本研究结合实地情况,在青木关地下河流域假设了5个潜在硝酸盐来源,分别为大气沉降、土壤有机氮、化肥(NO3-化肥与NH4+化肥)和粪肥污水;不同来源硝酸盐的δ15N-nitrate值和δ18N-nitrate值区间如表 2所示.
2.1. 样品采集
2.2. 实验方法
2.3. 数据分析
2.3.1. 阴阳离子平衡检验
2.3.2. MixSIAR模型
-
图 2为两流域水化学Piper图,可知两流域整体水化学特征相似. 除水房泉流域化粪池一个样品阳离子相对质量判定为Na+型,水化学类型判定为HCO3--Na+-Ca2+型(图 2),其余样品的阴阳离子相对质量浓度均大于50%,分别为HCO3-型和Ca2+型,两流域均以HCO3--Ca2+型为主要水化学类型(图 2). 两流域整体碳酸盐硬度均超过50%,这与前人研究结果吻合[29, 36],但根据图 2的Ca2+与Mg2+相对质量浓度分布情况,水房泉地下河水硬度略低于青木关地下河.
-
极差和标准差均指示数据离散程度,即波动程度. 表 3列出两流域各点NO3-与NH4+的平均质量浓度和标准差. 水房泉流域上游化粪池和青木关流域上游果园污水的NO3-与NH4+质量浓度分别为本流域最高(表 3);而水房泉流域最低NO3-与NH4+质量浓度均是下游水房泉(表 3),青木关流域则分别为中游岩口落水洞和下游姜家泉(表 3). 计算可知两流域NO3-与NH4+平均质量浓度极差,水房泉流域NO3-质量浓度极差9.16,NH4+质量浓度极差2.71;青木关流域NO3-质量浓度极差10.17,NH4+质量浓度极差4.21. 可知水房泉流域NO3-与NH4+质量浓度波动程度均低于青木关流域.
由表 3可知,水房泉流域上游化粪池NO3-与NH4+标准差分别为5.37,2.98;中游药池坝污水分别为2.08,2.58;下游水房泉分别为1.9,0.27. 青木关流域上游果园污水NO3-与NH4+标准差分别为6.03,2.52;中游岩口落水洞分别为4.96,2.34;下游姜家泉分别为5.33,2.52. 两流域硝酸盐空间波动特征分别为:水房泉流域上游NO3-与NH4+波动程度最大,中游至下游波动程度逐渐降低;青木关流域上游NO3-与NH4+波动程度最大,但中游波动程度低于下游. 对比发现,水房泉流域上、中、下游NO3-波动性均小于青木关流域,上、中游NH4+波动性略大于青木关上中游,下游NH4+波动性仍小于青木关下游.
-
表 4为两流域δ15N-nitrate与δ18O-nitrate值. 水房泉流域δ15N-nitrate最大值为11.03‰,最小值为-7.34‰,均值为3.93‰;δ18O-nitrate最大值为27.81‰,最小值为-9.35‰,均值为2.97‰. 青木关流域δ15N-nitrate最大值为13.11‰,最小值为1.51‰,均值为7.34‰;δ18O最大值为7.52‰,最小值为-17.66‰,均值为-0.07‰.
对比发现,水房泉流域δ15N-nitrate最大值、最小值和平均值均低于青木关流域,但水房泉流域δ18O-nitrate最大值、最小值和平均值均高于青木关流域.
-
利用氮氧同位素特征值方法识别NO3-来源,需要提前对反硝化作用进行识别[45]. 反硝化会导致同位素分馏,影响NO3-来源识别. 拟合NO3-质量浓度与δ15N-nitrate值关系,如果反硝化过程发生,NO3-质量浓度降低,δ15N-nitrate值升高[46]. 拟合两流域地下水NO3-质量浓度与δ15N-nitrate关系(图 3),可以看出,水房泉流域的R2=0.027,n=24,p<0.05,青木关流域的R2=0.157,n=18,p<0.05,NO3-质量浓度降低,δ15N-nitrate值并未升高.
前人的研究充分归纳出了硝酸盐来源的典型δ15N-nitrate,δ18O-nitrate值区间(表 2),作NO3-来源典型区间图(图 4),并将研究区数据(表 4)投射到这个典型区间.
土壤有机氮和粪肥污水是水房泉流域主要的硝酸盐来源(图 4a). 水房泉流域无化肥来源,有1个化肥池样品为化肥来源区间,5月、9月和10月化粪池样品在5个区间之外,可能是同位素分馏所致;8月药池坝污水落在大气降水来源区间,该点出露地表,受大气降水影响较大;9月药池坝污水落在土壤有机氮和粪肥污水区间下游,可能受这两种来源影响较大.
青木关流域主要来源是粪肥污水、化肥和土壤有机氮(图 4b). 其中5月姜家泉样品落在了土壤有机氮和粪肥污水区间下缘,可能受这两种来源影响较大;7-9月果园污水样品落在了化肥、土壤有机氮和粪肥污水来源区间的下方,该点硝酸盐来源较复杂.
水房泉流域污染源集中在土壤有机氮来源区间,而青木关流域这3种来源分布比较均衡,两流域硝酸盐来源构成可能存在较大区别.
-
硝化作用和反硝化作用是地下水中最常见的硝酸盐转化过程之一. 硝化反应由硝化菌主导,硝化菌活性主要受温度、溶解氧、pH值制约[47]. 反硝化作用的溶解氧质量浓度上限为2 mg/L[48],低于2 mg/L时,反硝化速率较高,2~6 mg/L时仍有较低速率的反硝化作用发生[49]. 硝化过程的最佳温度大约是30 ℃;硝化菌对pH值十分敏感,当pH值为8.0时,硝化速率最大,硝化反应将导致pH值下降[50].
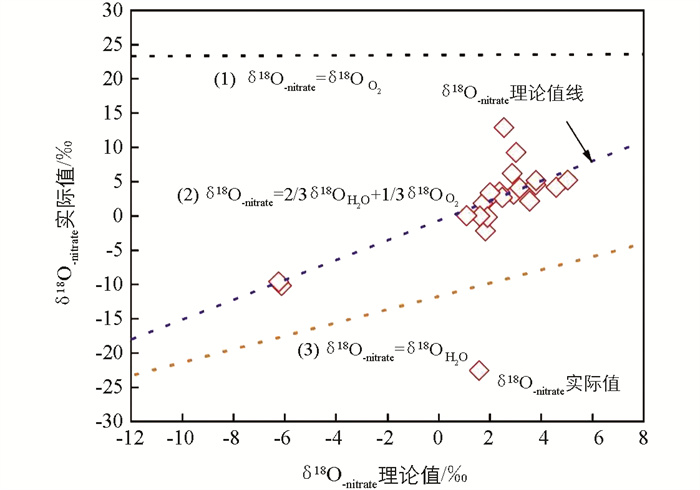
硝化作用并不属于一个完全的耗氧过程,氧元素会有明显的变化[51];硝化作用产生NO3-中的3个氧原子,其中有2个来自水分子,另外1个来自大气氧原子,最终生成的δ18O-nitrate值应在-10‰~10‰[46]. 可以对δ18O-nitrate理论值(2/3个水分子的δ18O值与1/3个氧原子的δ18O值之和)与δ18O-nitrate实际值进行验证,从而判断硝化作用.
图 5为两流域δ18O-nitrate理论值与实际值差异性的检验分析. 当δ18O-nitrate值落在理论值线上时,发生硝化作用. 经过配对样本t检验后发现,在0.05水平下,实际值与理论值不存在显著不同,认为两流域主要发生了硝化作用.
结合水化学数据来看(表 5),8月药池坝污水的溶解氧质量浓度为5 mg/L,9月下降至4.3 mg/L,为缺氧环境;8月水温较低为17.8 ℃,pH值降低可能是水温较低引起(水温较低时,CO2分压增高,CO2在水中的溶解度变高,导致CO2含量减少,CO2是光合作用的重要原料,其含量降低会直接导致水中有机质的光合作用速度变慢);8-9月NO3-质量浓度为较低值,也符合反硝化作用结果;5月、9月和10月化粪池样品溶解氧质量浓度分别为1.1,1.7,1.4 mg/L,溶解氧质量浓度低,有利于反硝化作用发生.
8-10月果园污水溶解氧质量浓度均低于3 mg/L,10月水温为17.8 ℃,均符合反硝化作用的条件;8月、9月电导率处于较高水平,在502~563 μS/cm区间内波动;长期有农民将果园污水用植物进行沤肥,导致植物有机质腐烂,因耗氧而处于还原环境,即使8月、9月水温较高,但反硝化作用仍可能发生.
-
将不同NO3-来源的同位素特征值、标准差、分馏系数引入到MixSIAR同位素混合模型,对水房泉和姜家泉NO3-的来源分别进行了解析. 由于反硝化作用较弱,因此分馏系数均取0[52].
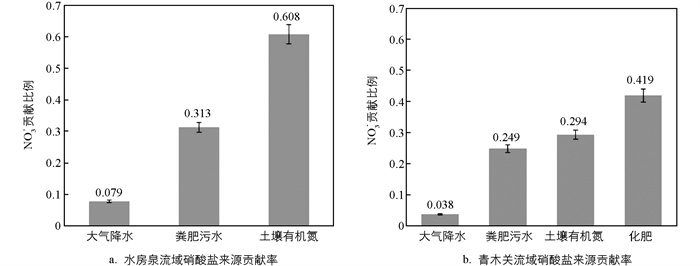
图 6a为水房泉流域NO3-来源平均贡献率解析. 土壤有机氮贡献率60.8%,粪肥污水和大气降水占比分别为31.3%和7.9%. 自然来源的土壤有机氮为流域最高,人为来源的粪肥污水占比较低. 由于水房泉流域以人为污染为主,加之植被覆盖率很高,自然来源远高于人为来源;大气降水来源很低,可能是空气较为洁净所致.
图 6b是青木关流域NO3-来源平均贡献率解析. 化肥来源贡献率41.9%,土壤有机氮贡献率29.4%,粪肥污水贡献率24.9%,大气降水贡献率3.8%. 化肥来源占比最高,证明该区域化肥来源硝酸盐污染最严重. 粪肥污水和土壤有机氮比较接近,这与水房泉流域完全不同,说明两个区域硝酸盐来源构成差异很大. 大气降水贡献率稍高于水房泉流域,但两者占比均较低.
-
MixSIAR是一种随机统计变量模型,每个来源估计的贡献比率在范围呈概率性分布. 将最大贡献率与最小贡献率之差除以0.95,可以得到该来源贡献率的不确定性指数(Uncertainty Index,UI95)[53],即贡献率的不确定性强度. UI95值越小,表明来源越稳定,时空异质性越小. 由于MixSIAR模型将不确定概率分为了0.25,0.5,0.75和0.95,结合研究区实际不确定性指数和硝酸盐来源情况,规定UI95值≤0.25表示“很稳定”,0.25<UI95值<0.5表示“较为稳定”,UI95值≥0.5表示“很不稳定”.
图 7为水房泉和青木关流域各潜在硝酸盐来源贡献频率分布图. 由图 7a可知,水房泉流域大气降水来源95%概率贡献率区间为4.9%~11.0%,UI95约为0.064,大气降水来源贡献很稳定,时空异质性很小. 土壤有机氮95%概率贡献率区间为41.4%~77.9%,UI95约为0.384,土壤有机氮来源较稳定. 粪肥污水95%概率贡献率区间为11.7%~52.3%,UI95约等于0.427,粪肥污水来源比较稳定.
图 7b可知,青木关流域大气降水来源很稳定,95%概率贡献率区间为0~16.7%,UI95约为0.175,略高于水房泉流域;粪肥污水来源很不稳定,95%概率贡献率区间为2.0%~68.4%,UI95约为0.698,远高于水房泉流域;青木关地下河化肥和土壤有机氮来源不稳定性很高,95%概率贡献率区间分别为3.9%~84.4%和2.4%~84.5%,UI95分别为0.847和0.864,土壤有机氮不稳定性远远高于水房泉地下河.
人为来源贡献率较大时,自然来源则相对低,自然来源贡献率高低受人为来源贡献率制约. 当人为来源贡献率高时,自然来源贡献率降低,表明该区域污染输入加重. 水房泉流域粪肥污水贡献率31.3%,不确定性为0.427,旅游酒店排污比较严重,且污染来源在时间上很不稳定. 青木关流域化肥来源贡献率41.9%,不确定性为0.698,流域化肥污染非常严重,且来源时间分配非常不稳定. 由于两个流域具有完全不同的主要人为污染源,在污染防控与治理上需要使用不同的方法. 例如,水房泉流域污染主要来源于旅游活动,该地为自然保护区,污染治理首先考虑地下水生态系统和环境保护;而青木关流域位于城镇郊区,农业活动比较发达,污染治理主要考虑农业化肥的管控,以及饮用水源的净化和治理.
3.1. 主要水化学指标特征对比
3.2. 硝酸盐时空变化特征对比
3.3. 硝酸盐来源识别与迁移转化过程对比
3.3.1. 硝酸盐同位素特征对比
3.3.2. 硝酸盐来源对比
3.3.3. 硝化与反硝化过程识别
3.3.4. 基于MixSIAR的硝酸盐来源的定量解析和贡献率解析
3.3.5. 硝酸盐来源的不确定性分析
-
(1) 水房泉地下河流域水化学类型为HCO3--Ca2+型和HCO3--Na+-Ca2+型,青木关地下河流域水化学类型为HCO3--Ca2+型,水房泉地下河水硬度略低于青木关地下河.
(2) 水房泉地下河流域整体NO3-与NH4+质量浓度波动程度均低于青木关地下河流域,但在水房泉地下河流域上游和中游,NH4+质量浓度波动程度略高于青木关地下河流域的上游和中游.
(3) 水房泉地下河和青木关地下河流域以硝化作用为主要的生物地球化学过程,但水房泉地下河流域上游和中游的9月药池坝污水和5月、9月和10月化粪池均发生反硝化作用,青木关地下河流域上游8-10月果园污水也发生了反硝化作用.
(4) 水房泉地下河流域硝酸盐主要来源于土壤有机氮来源,人为来源占比较低;青木关地下河流域化肥占比最高,土壤有机氮和粪肥污水占比也较高,人为来源占比远高于自然来源. 贡献率稳定性分析表明,水房泉地下河流域大气来源很稳定,土壤有机氮和粪肥污水均较稳定,不确定指数分别为:0.064,0.384和0.427;青木关地下河流域大气来源很稳定,粪肥污水贡献率很不稳定,化肥和土壤有机氮贡献率不稳定性极高,不确定指数分别为:0.175,0.698,0.847和0.864.



 下载:
下载: