-
开放科学(资源服务)标识码(OSID):

-
全球干旱和半干旱地区的面积已超过土地总面积的1/3,其中我国占近50%[1]。由于全球气候变化的持续波动,干旱的持续时间、频率和空间范围呈现增加趋势,未来可能会进一步恶化[2]。干旱不仅是限制植物发育的主要环境因素,也是制约森林生产力的关键因素[3]。研究表明,干旱胁迫会破坏活性氧(Reactive Oxygen Species,ROS)的产生与清除之间的平衡,从而影响正常的细胞代谢,并通过抑制植物光合作用、破坏植物渗透调节和抗氧化系统,限制植物的生长和发育[4]。
面对干旱胁迫,植物已进化出多种耐受机制,例如,产生抗氧化剂、诱导初级或次级代谢物,以及通过执行多种生理和代谢反应来适应干旱胁迫[5]。然而,这些植物自身的抗旱防御机制效果有限,因此应用化学调控技术成为缓解植物干旱损伤的重要途径。褪黑素(5-甲氧基-N-乙酰吲哚乙胺,N-acetyl-5-methoxytryptamine)是一种吲哚类化合物,在植物细胞中既作为生长促进剂,又作为抗氧化剂,是已知的抗氧化作用最强的内源性自由基清除剂[6]。褪黑素可以作为活性氧清除剂,缓解氧化损伤,并被广泛应用于缓解干旱、低温、盐碱、重金属等各种非生物胁迫。褪黑素调控干旱胁迫的研究已有许多报道,涵盖油菜(Brassica napus)[7]、绿豆(Mung Bean)[8]、猕猴桃(Actinidia chinensis Planch.)[9]、山核桃(Carya cathayensis)[10]、玉米(Zea mays L.)[9]和紫苜蓿(Medicago sativa)[8]等植物。研究表明,褪黑素可增加油菜幼苗的生物量,提升山核桃的抗坏血酸过氧化物酶(Ascorbate Peroxidase,APX)、脱氢抗坏血酸还原酶(Dehydroascorbate Reductase,DHAR)、谷胱甘肽还原酶(Glutathione Reductase,GR)等抗氧化酶活性,提高紫苜蓿的脯氨酸(Proline,Pro)、可溶性蛋白(Soluble Protein,Sp)等渗透调节物质的氧化应激能力[8]。目前,关于褪黑素调控不同植物耐旱生理过程及机制的研究尚存在差异。褪黑素可通过降低过氧化氢(H2O2)含量和增强APX活性缓解裸燕麦(Naked Oat)幼苗的干旱损伤[11];通过刺激酶促和非酶促抗氧化防御系统,提升活性氧清除效率,从而保护山核桃、猕猴桃和油菜等植物免受干旱诱导的氧化应激[7, 9, 12];通过调节脯氨酸代谢,缓解紫苜蓿的干旱损伤[13]。然而,目前关于褪黑素提高植物抗旱性主导因子的研究仍较为匮乏,这在很大程度上限制了对褪黑素调控植物干旱损伤的全面理解,也制约了利用褪黑素调控植物干旱损伤策略的制定。
红椿(Toona ciliata Roem.)是我国亚热带地区珍贵速生用材树种,被誉为“中国桃花心木”。红椿属于楝科香椿属的高大乔木,也是国家Ⅱ级重点保护植物,其心材呈深红褐色,纹理通直,结构细致,质地坚韧,花纹美观,是建筑、家具和室内装饰等的优良用材[14-16]。然而,红椿的生长旺盛期为7-9月,这恰逢重庆市季节性干旱的高发时段。在这一时期,红椿对水肥的需求量较大,面临严重的干旱胁迫。因此,研究红椿抗旱技术对其产业可持续发展至关重要。基于此,本试验采用盆栽控水法,以中度干旱强度处理2年生红椿幼苗,探究0.1 mmol/L褪黑素喷施叶片对红椿幼苗表观形态及生理特性的缓解作用,揭示褪黑素在红椿抗旱反应中的作用机制,并确定其缓解红椿地径、叶长、叶宽生长的关键调控因子,旨在为提高红椿等速生用材树种的抗旱性提供理论基础。
全文HTML
-
选用地径为0.6 cm、株高1 m、生长状况良好的红椿1年生幼苗为试验材料。于2019年7月,将幼苗移栽至直径25 cm、高20 cm的营养盆中,每盆填充5 kg的培养基质(原土∶泥炭土=2∶1),并配置统一的盆垫。幼苗在移栽后进行正常管护,并定期浇水。2020年7月,选取无病虫害、长势一致的幼苗用于试验。
-
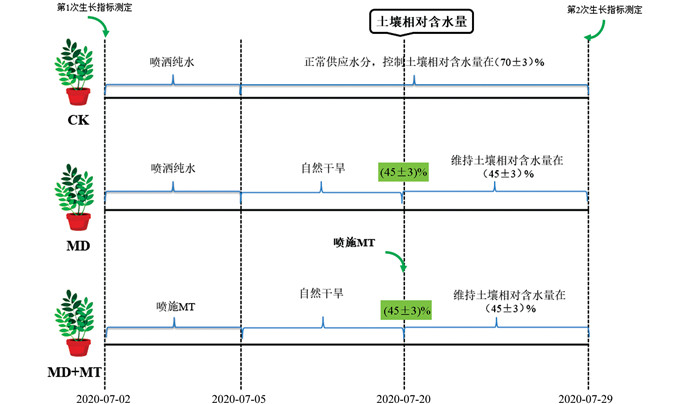
依据20世纪60年代以来重庆地区的气象数据,重庆地区主要以轻旱和中旱为主,且干旱集中在夏秋两季[17]。因此,本试验选择在夏季进行红椿幼苗中度干旱胁迫与缓解试验。试验参照《气象干旱等级》(GB/T 20481—2006),取中度干旱水平,即土壤相对湿度(土壤相对含水量)为40%~50%的中间值45%进行控水试验。本试验共设置3个处理:正常供水组(CK)、中度干旱组胁迫组(MD)、中度干旱胁迫+外源施加褪黑素组(MD+MT),每个处理选取3株幼苗,并进行3次重复试验,总计27株。干旱胁迫开始前,连续3 d对MD+MT组叶面喷施0.1 mmol/L褪黑素溶液,MD组和CK组喷施纯水,将各组浇透水(约为田间持水量的100%),然后开始自然干旱(CK组正常供水),用便携式土壤水分仪(DeltaTwetsensor,北京博伦经纬科技发展有限公司)监测土壤相对含水量,在土壤相对含水量达到中度干旱45%时(18 d后)开始控水,并对MD+MT组补喷施一次0.1 mmol/L褪黑素溶液(图 1)。控水过程中通过便携式土壤水分仪控制水分下限,称重法控制水分上限。
-
在喷施处理前和中度干旱胁迫处理后10 d进行生长指标的测定(图 1)。地径、叶长、叶宽等生长指标采用游标卡尺进行测量,并确保前后2次测量位置一致。
-
在中度干旱胁迫处理10 d后,采用Nikon Model C-LEDS体视显微镜对叶色进行观察并拍照记录。
-
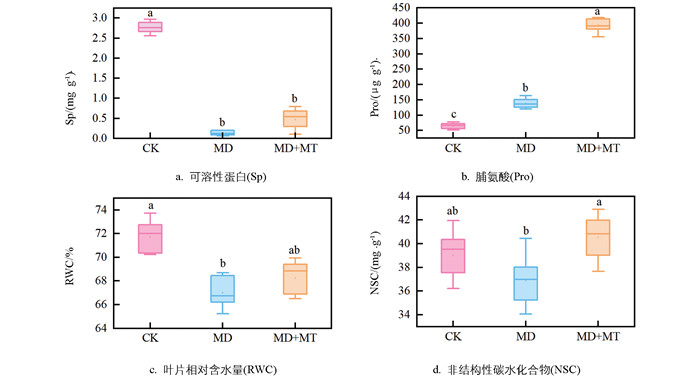
本试验的生理指标测定选用中度干旱胁迫处理后第10 d采集的各处理植株新稍下方第3~5叶序的完整功能叶进行分析(图 1)。每个指标重复测定3次。叶片相对含水量(Relative Water Content of Leaves,RWC)采用烘干称重法测定;可溶性糖(Soluble Sugars,Ss)及淀粉(Starch,St)采用蒽酮乙酸乙酯-浓硫酸法测定[18];可溶性蛋白(Sp)采用考马斯亮蓝法测定;丙二醛(Malondialdehyde,MDA)采用硫代巴比妥酸法测定[18];过氧化氢(H2O2)采用碘化钾法测定[19];抗坏血酸(Ascorbic Acid,AsA)采用BP显色法测定[19];脱氢抗坏血酸(Dehydroascorbic Acid,DHA)用二硫苏糖醇-乙醇溶液还原后测定总AsA含量,减去抗坏血酸组测得的AsA含量即为DHA含量[19];谷胱甘肽(Reduced Glutathione,GSH)、氧化型谷胱甘肽(Oxidized Glutathione,GSSG)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(Glutathione Reductase,GR)、脱氢抗坏血酸还原酶(Dehydroascorbate Reductase,DHAR)、单脱氢抗坏血酸还原酶(Monodehydroascorbate Reductase,MDHAR)均采用上海优选生物科技有限公司试剂盒进行测定。
-
使用Microsoft office 2016进行数据整理和表格制作,用SPSS 19.0进行方差分析和相关分析,利用Duncan法进行多重比较,LSD法进行两两比较,显著性水平设为0.05[14]。采用Origin 64进行图形的绘制。使用CANOCO 5.0软件进行冗余分析(Redundancy Analysis,RDA),并通过基于随机排序的蒙特卡罗法检验特征值的显著性[20]。基于RDA分析的简单效应和条件效应筛选指标,确定褪黑素缓解红椿干旱损伤的主要生理因子。
1.1. 试验材料
1.2. 试验设计
1.3. 测定方法
1.3.1. 生长指标
1.3.2. 形态观察
1.3.3. 生理指标
1.4. 数据处理与统计学分析
-
研究结果显示,干旱处理显著抑制了红椿幼苗的生长,相比于正常供水组,地径增量、叶长增量和叶宽增量均显著减小(p<0.05)。喷施褪黑素后,能够有效缓解干旱对红椿生长的抑制作用,地径增量、叶长增量和叶宽增量相比于中度干旱胁迫组分别提高了29.09%、15.77%和13.21%(表 1),表明褪黑素具有缓解干旱抑制红椿生长的效果。在干旱胁迫条件下,红椿幼苗自下方起叶柄黄化脱落较为严重,且叶片萎蔫程度最为明显;外源施加褪黑素后,叶片脱落变少,萎蔫程度较干旱组明显减轻(表 2)。干旱胁迫使红椿叶片颜色变浅,喷施褪黑素后,叶色恢复为深绿色(图 2)。
-
褪黑素对红椿渗透物质具有明显调节作用。与中度干旱胁迫组相比,褪黑素处理的红椿幼苗叶片可溶性蛋白(Sp)、脯氨酸(Pro)、非结构性碳水化合物(Non-structural Carbohydrates,NSC)的质量分数和叶片相对含水量(RWC)分别提高了22.67%、186.40%、10.72%和3.33%,且非结构性碳水化合物显著恢复(p<0.05)至接近对照组水平(图 3)。这表明褪黑素能够促进渗透调节物质的合成和积累,降低细胞渗透势,保护细胞结构与功能,从而增强植物的渗透调节能力。
-
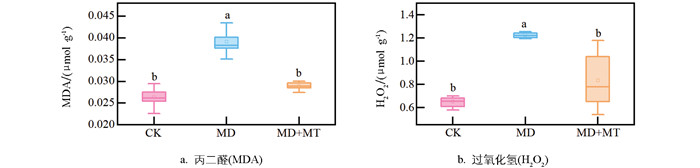
褪黑素处理下,红椿叶片的丙二醛(MDA)和过氧化氢(H2O2)含量相比干旱组分别降低了31.72%和25.89%,且均显著降低至接近对照组水平(图 4)。这表明褪黑素能够有效清除H2O2,维持活性氧平衡,从而减轻活性氧对细胞膜的氧化损伤,保持细胞膜完整性。
-
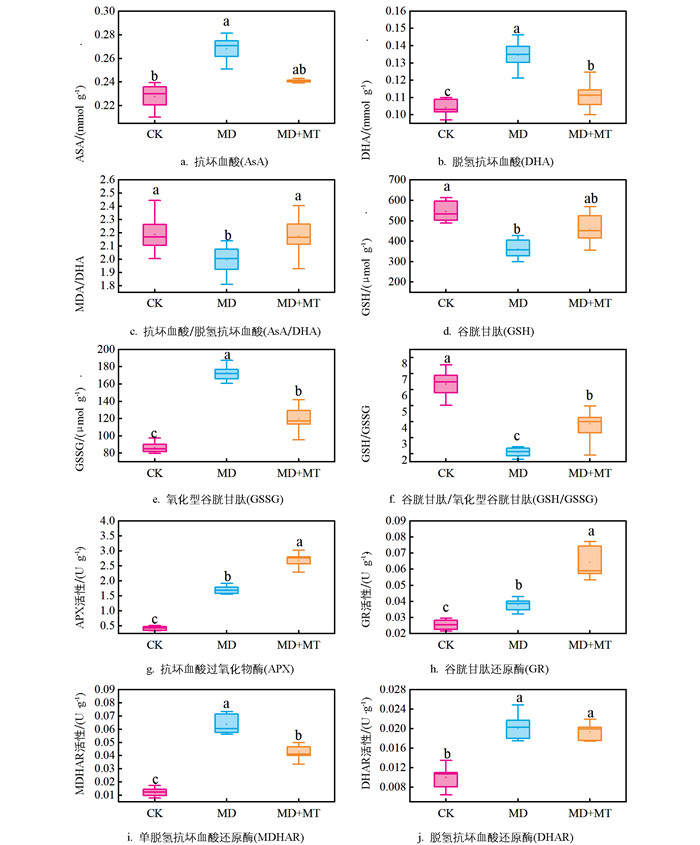
褪黑素对红椿叶片AsA-GSH循环的影响如图 5所示。与中度干旱胁迫组相比,褪黑素处理的红椿幼苗叶片中抗坏血酸(AsA)、脱氢抗坏血酸(DHA)含量分别降低了10.14%和17.77%,差异均具有统计学意义(p<0.05);其中DHA含量显著下降至接近对照组水平,褪黑素显著提高了红椿叶片的AsA与DHA的比值,表明褪黑素可通过提高AsA循环效率缓解干旱损伤。
褪黑素处理后,红椿幼苗的叶片谷胱甘肽(GSH)含量较中度干旱胁迫组提高了26.33%,而氧化型谷胱甘肽(GSSG)含量较干旱组降低了30.12%,差异均具有统计学意义(p<0.05),且均恢复至接近对照组水平。褪黑素显著提高了GSH与GSSG的比值,表明褪黑素通过促进GSH生成并抑制GSSG生成,提高GSH循环效率以缓解干旱损伤。
褪黑素处理后,抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性分别较中度干旱胁迫组提高了58.11%和69.32%,差异具有统计学意义(p<0.05),而脱氢抗坏血酸还原酶(DHAR)和单脱氢抗坏血酸还原酶(MDHAR)活性分别下降了3.64%和32.42%,其中MDHAR活性与干旱组比较,差异具有统计学意义(p<0.05),表明褪黑素主要通过提高APX和GR酶活性以缓解干旱损伤。
-
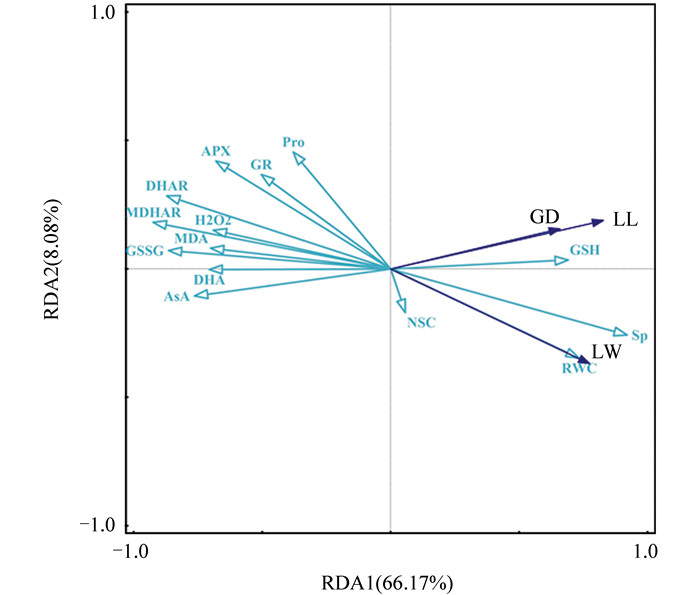
为进一步揭示褪黑素缓解红椿干旱损伤的主要调控因子,对3个生长指标和15个生理因子进行了冗余分析,结果如图 6所示;采用前向选择法筛选关键调控因子,并对所有生理因子的简单效应与条件效应进行了比较,结果如表 3所示。在简单效应分析中,有7个因子的贡献率均超过40.0%,分别为单脱氢抗坏血酸还原酶(MDHAR)、氧化型谷胱甘肽(GSSG)、非结构性碳水化合物(NSC)、抗坏血酸(AsA)、脱氢抗坏血酸还原酶(DHAR)、丙二醛(MDA)和可溶性蛋白(Sp),其中5个属于活性氧(ROS)代谢调控因子,2个为渗透调节因子。
在条件效应分析中,仅有2个因子的贡献率超过5.0%,分别为MDHAR和AsA,二者同为活性氧代谢调控因子。综合简单效应和条件效应分析结果,在14个生理因子中,褪黑素处理下,MDHAR和AsA对地径增量(GD)、叶长增量(LL)和为叶宽增量(LW)这3个生长指标的调控能力均达到显著水平(p<0.05),其共同贡献率为61.9%,解释能力强且稳定,是褪黑素缓解红椿干旱损伤的主要调控因子,其中MDHAR为核心主导地位。
2.1. 褪黑素对红椿的生长和叶片形态的影响
2.2. 褪黑素对红椿渗透调节物质的影响
2.3. 褪黑素对红椿叶片活性氧代谢的影响
2.3.1. 褪黑素对红椿叶片活性氧水平和脂质过氧化程度的影响
2.3.2. 褪黑素对红椿叶片AsA-GSH循环的影响
2.4. 褪黑素缓解红椿干旱损伤的主要调控因子
-
干旱是限制植物生长的主要非生物胁迫因子,能够显著抑制植物的生长与生理活动。本研究结果显示,在中度干旱胁迫条件下,红椿幼苗的地径增量、叶长增量、叶宽增量明显下降,叶尖枯黄、叶色变浅、叶片严重萎蔫并脱落,表明干旱显著抑制了红椿的正常生长。褪黑素处理后,上述抑制现象得到明显缓解,说明褪黑素减轻了干旱对红椿幼苗地径、叶长、叶宽的抑制作用,有助于提升红椿对水分的吸收能力,减轻干旱胁迫带来的生理伤害。褪黑素在多种植物中均具有缓解干旱胁迫的作用,但对不同植物的缓解作用存在量效上的差异。例如,叶面喷施0.05 mmol/L褪黑素对沙芦草(Agropyron mongolicum)生长无明显缓解作用,但对玉米幼苗则具有显著的促进作用[21-22];叶面喷施0.2 mmol/L褪黑素对向日葵(Helianthus annuus L.)无明显缓解作用,但喷施0.1 mmol/L褪黑素具有较明显的缓解作用;0.1 mmol/L褪黑素对达乌里胡枝子(Lespedeza davurica)有明显缓解作用,而0.05 mmol/L褪黑素则缓解作用不明显[22-23]。本研究中,0.1 mmol/L褪黑素对红椿幼苗的生长具有显著的缓解效果,进一步表明适宜浓度的褪黑素可有效增强植物对干旱胁迫的适应能力。
-
干旱胁迫会引发植物渗透调节失衡,抑制植物对水分的吸收,从而影响其正常生长发育。渗透调节系统是植物在干旱条件下应对水分胁迫的首要防御机制,对于维持细胞膨压、保护细胞结构与功能具有重要作用[24]。非结构性碳水化合物(NSC)主要由可溶性糖和淀粉构成,是植物光合作用产物的短期储备形式,其储量可反映植物的能量储备水平,对植物生长、存活及抵御干旱等胁迫具有重要意义[25]。可溶性蛋白(Sp)作为植物的储存蛋白,能够储存并释放氮、磷等营养元素,从而维持植物的正常生理活动,在逆境胁迫中发挥关键作用[26]。本研究结果表明,在干旱胁迫下,褪黑素处理能显著提高红椿幼苗叶片中NSC、Sp、Pro、RWC的质量分数,其中NSC和Pro的提升达到显著水平(p<0.05)。这表明褪黑素通过增加细胞内渗透调节物质的积累,维持细胞水分平衡,从而有效缓解红椿的干旱伤害。尽管干旱胁迫下褪黑素对渗透系统普遍具有调控作用,但其调控机制在不同植物中存在差异。例如,褪黑素可通过抑制蛋白质降解、促进新蛋白质合成来提高葡萄的渗透调节能力和细胞保水能力以缓解干旱损伤[27],也可能通过调节脯氨酸代谢来增强紫苜蓿的干旱能力[13]。在本研究中,干旱胁迫导致红椿根系吸水能力下降,进而影响氮素吸收和蛋白质合成。褪黑素可能通过促进红椿体内氨基酸的合成,提高Sp积累量,从而增强红椿的抗旱能力[28]。综上所述,褪黑素可能通过维持渗透系统平衡、促进抗旱相关蛋白和储能物质的合成,有效提升红椿对干旱胁迫的耐受能力。
-
干旱胁迫打破活性氧生成与清除之间的平衡,从而引发植物细胞发生氧化应激[29]。若活性氧无法及时清除,在植物细胞中过度积累,则会造成蛋白质氧化、膜质过氧化以及遗传物质损伤[30-31]。干旱胁迫通过破坏植物体内的活性氧平衡,导致大量活性氧物质外泄,过多的自由基无法及时清除,会加速膜脂过氧化过程,降低膜系统的完整性,进而损伤蛋白质,最终引发植物体内生理与生化代谢紊乱,抑制其正常的生长发育[32-33]。本研究结果表明,在干旱胁迫下,褪黑素处理显著降低了红椿叶片中H2O2和MDA含量(p<0.05),表明褪黑素在减少活性氧代谢产物、维持活性氧动态平衡方面具有重要作用。
为了缓解干旱引起的氧化应激损伤,植物依赖酶促与非酶促抗氧化系统的协同作用以增强抗旱能力[34]。抗坏血酸-谷胱甘肽(AsA-GSH)循环是植物体内重要的抗氧化系统之一,也是清除活性氧的关键代谢通路,由抗氧化物质AsA、GSH及多种关键酶共同构成[22]。其中,AsA与GSH有助于维持细胞内蛋白质的稳定性、保持生物膜结构的完整性,并有效降低膜脂过氧化水平;而APX、DHAR、MDHAR、GR等酶则构成高效的自由基清除体系[35]。在AsA-GSH循环中,AsA在APX的催化下与H2O2发生反应,将其还原为H2O,同时自身被氧化生成MDHA。MDHA一部分在MDHAR作用下还原为AsA,重新进入循环;另一部分被进一步氧化为DHA,DHA则在DHAR催化下以GSH为底物重新还原为AsA。该反应产生的GSSG随后在GR的作用下,在NADPH供能下被还原回GSH[35-36]。本研究中,褪黑素处理显著提升了红椿叶片中APX、GR活性及GSH含量(p<0.05),表明其可通过增强关键酶活性促进AsA对活性氧的清除。此外,褪黑素显著提高了AsA/DHA与GSH/GSSG的值,进一步说明其能有效增强AsA-GSH循环的运转效率。尽管干旱胁迫下褪黑素普遍对植物AsA-GSH循环具有调节作用,但调控的主导因子存在物种差异。已有研究指出,褪黑素可通过调控苹果和番茄中APX、DHAR、MDHAR和GR的活性来促进AsA-GSH循环[37-38];而在桃子中,主要通过增强APX活性、降低MDA与H2O2含量以应对干旱胁迫[39]。本研究的RDA分析表明,MDHAR与AsA是褪黑素缓解红椿干旱损伤的核心调控因子。其中,MDHAR作为AsA代谢路径中的关键酶,其活性在干旱条件下上升,可将AsA的氧化产物MDHA还原为AsA,对维持细胞内AsA水平和氧化还原平衡发挥关键作用[40]。本研究结果表明,干旱胁迫激发了红椿叶片中抗坏血酸防御系统,使加快AsA循环再生的MDHAR酶活性上升,从而维持叶片AsA水平和缓解干旱对红椿的伤害。综合来看,褪黑素通过提高AsA-GSH循环效率、增强抗氧化酶活性以及提升非酶抗氧化剂水平,有效清除积累的ROS,减缓干旱引起的膜脂过氧化,恢复细胞膜功能,从而减轻氧化应激反应,缓解红椿的干旱损伤[41]。
-
干旱胁迫显著抑制了红椿幼苗的生长发育,而褪黑素可有效提高其抗旱能力。研究表明,褪黑素可通过促进抗旱相关功能蛋白的合成,维持细胞渗透平衡,并增强AsA-GSH循环的活性,有效清除体内H2O2,从而减轻干旱带来的氧化损伤,缓解红椿的干旱胁迫反应。进一步分析表明,MDHAR与AsA是褪黑素缓解红椿干旱损伤的关键生理调控因子,其中以MDHAR为主导。本研究为开发以褪黑素为基础的植物抗旱调节剂提供了理论依据,对提升干旱环境下红椿产业的可持续发展水平具有重要意义。



 下载:
下载: