-
岩藻多糖(fucoidan),也被称为褐藻糖胶,是一种由岩藻糖硫酸酯构成的水溶性多糖,具有广泛的生物活性,如抗氧化、抗病毒及抑制幽门螺旋杆菌等[1]. 岩藻多糖在褐藻中的含量低(大约0.1%),存在提取工艺复杂、提取率低等限制,从而影响对岩藻多糖生理活性的研究和应用开发[2]. 微生物来源的岩藻多糖主要是指含岩藻糖胞外多糖(fucose-containing exopolysaccharide,FucoPol),产FucoPol菌株主要来源于肠杆菌属和芽孢杆菌属[3]. FucoPol的分子结构中不含硫酸基,导致其生物活性不足[4],但其优势是可以通过基因工程改造和发酵工艺优化等手段来提升产量,实现大规模工业化生产.
多糖硫酸化修饰是一种通过化学法在多糖的分子链上接枝硫酸基团的方法. 硫酸化修饰可以增强原多糖的某些活性或产生新的生物活性,如免疫活性、抗病毒活性及抗菌活性等,其中抗氧化活性的增强备受研究者关注. Xu等[5]对黑加仑多糖进行硫酸化修饰,体外实验表明硫酸化黑加仑多糖比黑加仑多糖具有更强的抗氧化活性和a-淀粉酶抑制活性;Liu等[6]对梭柄松苞菇子实体多糖(mCVP-1S)进行硫酸化改性,发现硫酸化实体多糖具有更好的体外抗氧化活性及抗凝血活性,并发现取代度和三螺旋结构是影响其生物活性的重要因素;Zhang等[7]发现硫酸化植物乳杆菌胞外多糖显示出比原始胞外多糖更强的自由基清除活性,硫酸化胞外多糖可以保护Caco-2细胞免受蜡状芽孢杆菌肠毒素引起的损伤.
本研究以本课题组筛选的Kosakonia sp. CCTCC M2018092菌株发酵产生的FucoPol为原料[8],通过化学法进行硫酸化修饰,在分子结构中引入硫酸基团,并对硫酸化FucoPol(FucoPol-S)进行红外和核磁表征,测定硫酸基含量,以及体外抗氧化活性及细胞相容性,为实现FucoPol的应用开发奠定基础.
全文HTML
-
FucoPol由Kosakonia sp. CCTCC M2018092菌株发酵产生;Fucoidan,上海麦克林生化科技有限公司;氯磺酸、吡啶、硫酸亚铁、过氧化氢溶液、氯化硝基四氮唑蓝、β-烟酰胺腺嘌呤二核苷酸和吩嗪硫酸甲酯均为分析纯,上海易恩化学技术有限公司;胎牛血清、DMEM培养基、100×青霉素-链霉素溶液,重庆睿宸生物科技有限公司.
-
TGL-16M型台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;600 MHz核磁共振波谱仪,瑞士布鲁克仪器有限公司;Synergy H1型酶标仪,美国安捷伦科技有限公司.
-
小鼠巨噬细胞RAW 264.7细胞株,Kosakonia sp. CCTCC M2018092菌株由本实验室保存.
-
参考Li等[9]方法进行FucoPol的发酵和分离提取. Kosakonia sp. CCTCC M2018092菌株首先在250 mL锥形瓶中培养活化20 h,菌液转移到15 L种子罐中预培养13 h,预生长的种子液转移到50 L发酵罐中进行分批补料发酵96 h.
发酵结束后,发酵液进行部分酸水解降低粘度以便于进行后续的分离提纯. 发酵液使用浓硫酸调节pH值至2.0,在80 ℃下水解4 h. 使用陶瓷膜过滤除去发酵液中的菌体和不溶性杂质. 使用截留分子量为10 000 g/mol的高分子膜进行超滤以进一步去除小分子杂质. 接着,通过Sevag法脱蛋白,最后通过透析(截留分子量8 000 g/mol)和冻干得到FucoPol.
-
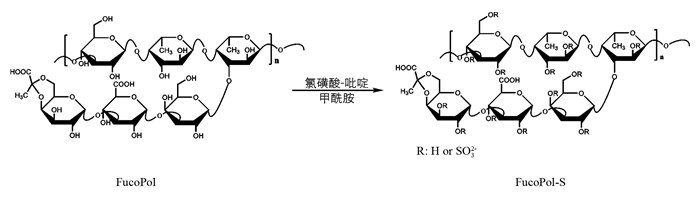
采用氯磺酸-吡啶法进行FucoPol的硫酸化[10]. 在磁力搅拌和冰水浴冷却的条件下,将6 mL氯磺酸通过恒压滴液漏斗缓慢加入12 mL无水吡啶中,在40 min内滴加完成,得到淡黄色固体状硫酸化试剂.
将500 mg FucoPol粉末加入20 mL甲酰胺,于室温下磁力搅拌分散30 min. 加入硫酸化试剂,于50 ℃反应2 h. 冷却至室温,使用4 mol/L NaOH溶液调整反应液的pH值至7.0左右,使用3倍体积乙醇沉淀硫酸化多糖. 5000 r/min离心5 min后弃去上清液,使用去离子水溶解沉淀,流水透析(截留分子量3 500 g/mol)12 h,去离子水中透析24 h. 透析液冻干后得硫酸化多糖(FucoPol-S).
-
通过傅里叶变换红外光谱(FT-IR)和核磁氢谱(1HNMR)进行结构表征. 制备的硫酸化多糖样品使用常规方法压片,采用傅里叶变换红外光谱仪扫描分析(扫描范围400~4 000 cm-1);取5 mg干燥的多糖样品溶解于0.5 mL氘代水中,内标为TMS,进行1HNMR分析.
硫酸化多糖中的硫酸根含量采用比浊法[11]测定. 将3 mg FucoPol-S溶解于5 mL 1 mol/L HCl中,压盖密封后于100 ℃水解6 h,水解液冷却至室温后过滤除去沉淀备用. 分别取1.48 mg/mL的硫酸钠标准溶液(SO42-质量浓度为1.00 mg/mL)0.04,0.06,0.08,0.10,0.12,0.14,0.16 mL,使用1 mol/L盐酸补齐至0.20 mL. 向其中加入3.8 mL 3%三氯乙酸溶液和1.0 mL氯化钡-明胶溶液(含0.5%明胶和0.5%氯化钡),混匀后室温静置15 min,在360 nm波长测定吸光度值A1. 以0.5%明胶溶液代替明胶-氯化钡溶液作为空白,测吸光度值A2,以吸光度差值(A1-A2)和硫酸基质量分数作标准曲线. 取0.20 mL硫酸化多糖水解液使用上述方法测吸光度值,使用标准曲线计算硫酸根质量. 使用以下公式计算硫酸化多糖中的硫酸基质量分数:
式中:S为硫酸化多糖中的硫酸基质量分数;m2为硫酸根质量,单位为mg;m1为硫酸化多糖质量,单位为mg.
-
参考Chen等[12]的方法测定岩藻多糖、FucoPol-S和FucoPol羟基自由基(·OH)清除活性. 使用去离子水配制不同浓度的样品溶液. 在96孔板中,将160 μL样品溶液与40 μL 9 mmol/L FeSO4溶液和40 μL 8.8 mmol/L H2O2溶液充分混合,再加入20 μL 9 mmol/L水杨酸-乙醇溶液. 混合均匀后,于37 ℃静置30 min,并于酶标仪上测定510 nm处吸光度. 维生素C(Vc)作为阳性对照,以去离子水替代多糖溶液作为空白,每组设置3个重复孔. 计算·OH清除率:
式中:Y1为·OH清除率;A0为空白孔吸光度;A1为样品孔吸光度.
-
参考Lin等[13]的方法测定岩藻多糖、FucoPol-S和FucoPol的超氧阴离子(·O2-)清除活性. 使用去离子水配制不同浓度的多糖溶液. 在96孔板中,将50 μL多糖溶液与100 μL 150 μmol/L氯化硝基四氮唑蓝(NBT)溶液和100 μL 470 μmol/L β-烟酰胺腺嘌呤二核苷酸(β-NADH)溶液混合均匀,再加入20 μL 20 μmol/L吩嗪硫酸甲酯(PMS)溶液. 混合均匀后,在室温下静置5 min,并于酶标仪上测定560 nm处吸光度. Vc作为阳性对照,以去离子水替代多糖溶液作为空白,每组设置3个重复孔. 计算超氧阴离子自由基清除率:
式中:Y2为超氧阴离子清除率;A0为空白孔吸光度;A1为样品孔吸光度.
-
小鼠巨噬细胞RAW264.7细胞在完全培养基(补充有100 U/mL青霉素、100 μg/mL链霉素和10%胎牛血清的DMEM培养基)中生长,并在37 ℃,5%CO2的细胞培养箱中培养.
通过CCK-8试剂盒测定FucoPol-S对RAW264.7细胞的细胞毒性[14-15]. 在96孔板中接种100 μL稀释至5.0×104个/mL的细胞,每组设6个重复孔. 培养12 h后,弃去原培养基,分别用100 μL以完全培养基溶解的FucoPol-S(12.5 μg/mL至50 μg/mL)处理细胞24 h. 将多糖溶液替换为等体积完全培养基作为空白组. 随后,向每个孔中加入10%CCK-8溶液,于37 ℃孵育2 h,使用酶标仪测定450 nm处的吸光度. 计算细胞活力:
式中:V为细胞活力;A0为空白组吸光度;A1为多糖实验组吸光度.
-
参考邹灵秀等[16]的方法进行细胞氧化损伤模型构建. 在96孔板中接种100 μL以完全培养基稀释至5.0×104个/mL的RAW 264.7细胞,每组设6个重复孔. 培养12 h,弃去原培养基,用100 μL DMEM培养基稀释的不同浓度H2O2(0~900 μmol/L)处理细胞12 h. 随后,向每个孔中加入10%CCK-8溶液,于37 ℃孵育2 h,使用酶标仪测定450 nm处的吸光度. 计算细胞活力.
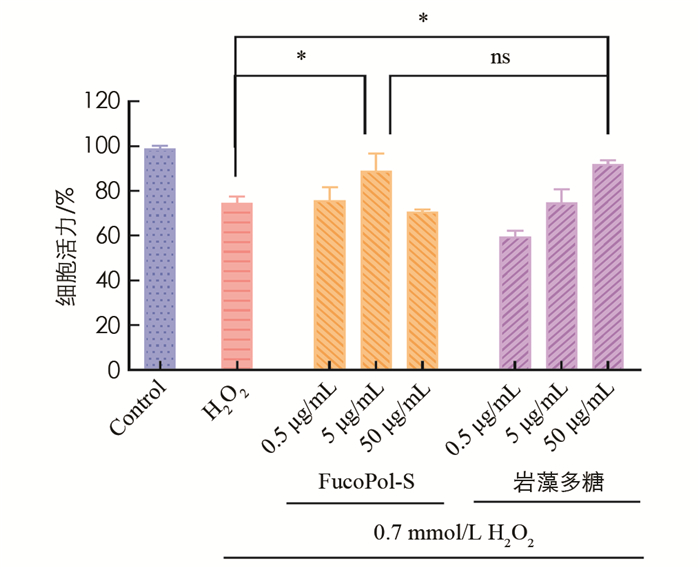
参考Zhang等[17]的方法进行细胞抗氧化实验. 在96孔板中接种100 μL以完全培养基稀释至5.0×104 cell/mL的RAW 264.7细胞,每组设6个重复孔. 培养12 h,弃去原培养基,实验组用100 μL完全培养基稀释的不同质量浓度的FucoPol-S(0.5~50 μg/mL)和岩藻多糖(0.5~50 μg/mL)处理细胞24 h. 随后,加入100 μL 1.5 mmol/L DMEM培养基稀释的H2O2溶液,培养12 h. 空白组以等体积完全培养基替代多糖溶液,等体积DMEM培养基替代过氧化氢溶液. 过氧化氢对照组以等体积完全培养基替代多糖溶液. 最后,向每孔加入10%CCK-8溶液,于37 ℃孵育2 h,使用酶标仪测定450 nm处的吸光度. 计算细胞活力.
-
使用GraphPad Prism 8.0软件绘制实验数据相关图片. 实验结果是3次及以上分析的平均值,使用SPSS 18.0软件进行数据显著性分析,p < 0.05表示数据差异具有统计学意义.
1.1. 试剂
1.2. 仪器与设备
1.3. 细胞和菌株
1.4. 实验方法
1.4.1. 胞外多糖制备及分离提取
1.4.2. 硫酸化多糖制备
1.4.3. 硫酸化修饰验证
1.4.4. 羟基自由基清除活性测定
1.4.5. 超氧阴离子清除活性测定
1.4.6. 细胞毒性测定
1.4.7. 细胞抗氧化活性测定
1.4.8. 数据统计分析
-
发酵液经酸水解、膜过滤、透析冻干后得到FucoPol. 500 mg FucoPol硫酸化得到558 mg FucoPol-S,产率111.6%(图 1). 通过比浊法在FucoPol中未检测到硫酸基存在,而测得FucoPol-S和岩藻多糖硫酸基含量分别为28.2%,20.7%.
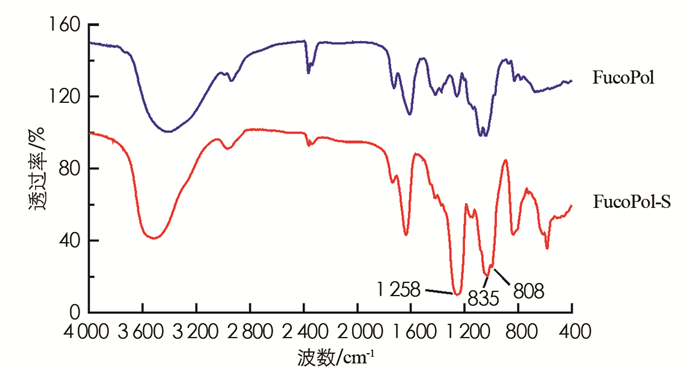
在FucoPol-S的FT-IR光谱中出现了硫酸基团的特征吸收带,1 258 cm -1附近的条带归属于不对称S=O双键的伸缩振动,证明硫酸基团成功引入[17]. 800~850 cm-1左右的吸收带由C-O-S对称振动引起,该范围的红外吸收可用来推断硫酸基团在硫酸化多糖中的取代位置,在含半乳糖单元的多糖中845 cm-1,830 cm-1和820 cm-1位置的条带分别分配给的C-4硫酸化、C-2硫酸化和C-6硫酸化[18]. FucoPol-S的红外光谱中在808 cm-1和832 cm-1出现了吸收峰,可以推断FucoPol的硫酸化主要发生在C-6和C-2位置(图 2).
在FucoPol-S的1HNMR图中,归属于岩藻糖甲基的质子峰化学位移值向低场移动(由1.29移至1.44),提示在岩藻糖单元上发生了硫酸化修饰[19]. 而化学位移3.2~4.6之间归属于岩藻糖、葡萄糖、半乳糖和葡萄糖醛酸的质子峰都整体向低场方向发生了移动,说明硫酸化修饰随机发生在各个单糖单元的羟基上.
-
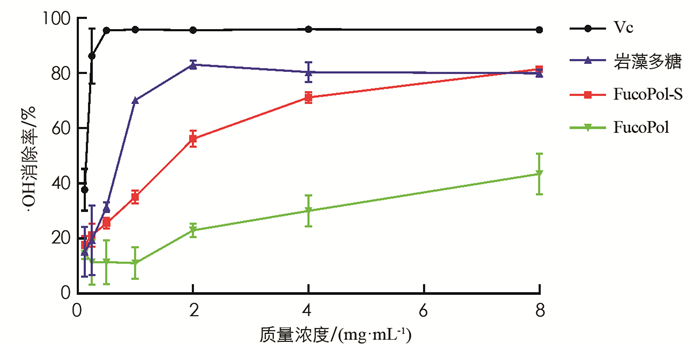
羟基自由基(·OH)是人体内存在的活性氧之一,其能轻易地穿过细胞膜并与碳水化合物、蛋白质和DNA等生物大分子发生反应,是导致细胞氧化损伤的主要原因. 因此,减少·OH对于人体健康具有重要意义. 采用Fenton试剂产生·OH,测定岩藻多糖、FucoPol-S和FucoPol对·OH的清除活性(图 3). 3种多糖的·OH清除率具有浓度依耐性,半数抑制质量浓度分别为IC50(岩藻多糖)=0.67 mg/mL;IC50(FucoPol-S)=1.82 mg/mL;IC50(FucoPol)>8.00 mg/mL. 当质量浓度增达到8.0 mg/mL时,FucoPol-S的·OH清除率为81.61%,岩藻多糖的·OH清除率为80.34%,两者差异无统计学意义(p>0.05),FucoPol的·OH清除率为43.37%,显著小于FucoPol-S(p < 0.05). 对比FucoPol-S和FucoPol,结果显示硫酸化修饰显著增强了岩藻多糖的·OH清除活性,说明硫酸根在清除·OH中起重要作用. 对比FucoPol-S和岩藻多糖,结果显示FucoPol-S的半数抑制质量浓度高于岩藻多糖,但高质量浓度时两者·OH清除活性相当. Wang等[20]研究表明硫酸化多糖可能通过螯合Fe2+来减少·OH的产生,我们推测高取代度的硫酸化多糖中可用于螯合Fe2+的羟基减少,可能是高取代FucoPol-S ·OH清除活性略低于Fucoidan的原因.
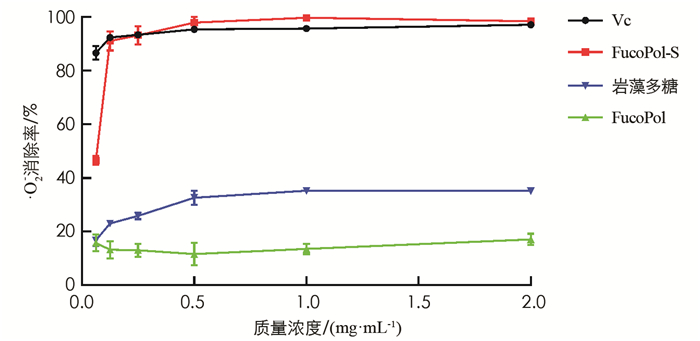
超氧阴离子(·O2-)是单线态氧和羟基自由基的前体之一,它会间接引发体内的氧化损伤. 通过PMS/NADH/NBT体系测定·O2-清除活性(图 4). 结果显示FucoPol-S的·O2-清除率随质量浓度增加迅速增加,并在0.25 mg/mL时达到93.06%,效果与相同质量浓度的Vc相当,在实验质量浓度(0.0625~2.00 mg/mL)范围内,均显著高于FucoPol和FucoPol-S. 其中IC50(FucoPol)>2.00 mg/mL;IC50(Fucoidan)>2.00 mg/mL;IC50(FucoPol-S)=0.073 mg/mL. Chen等[21]研究表明清除·O2-的机理可能与O—H键能有关,即多糖上带有的吸电子基团数越多,O—H键能越弱,O—H键越容易解离出氢原子,从而稳定·O2-.
-
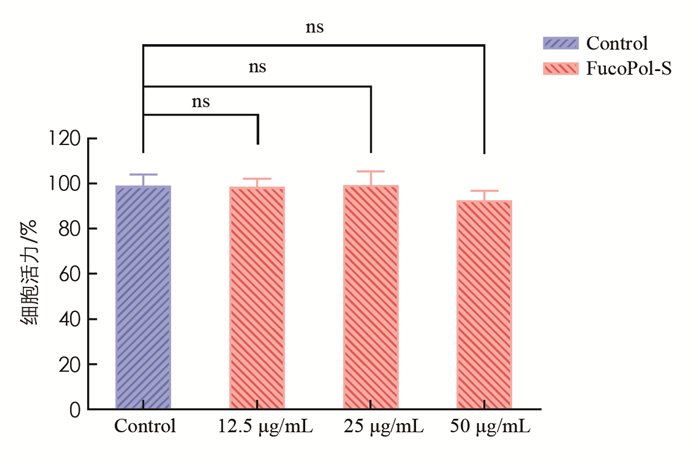
使用不同质量浓度的FucoPol-S处理RAW 264.7细胞24h后,结果显示50 μg/mL及以下均未显示出细胞毒性,说明FucoPol-S具有较好的生物安全性(图 5).
用浓度递增的过氧化氢溶液处理RAW 264.7细胞12 h后,其细胞活力逐渐降低,当过氧化氢浓度达到0.9 mmol/L时,细胞活力降至25.59%. 其中,当浓度为0.7 mmol/L时,细胞活力为54.86%. 基于该结果,后续实验将使用0.7 mmol/L过氧化氢处理12 h作为细胞氧化损伤条件.
细胞抗氧化实验中,比较了不同质量浓度的FucoPol-S和岩藻多糖对过氧化氢诱导的RAW 264.7细胞活力丧失的保护作用(图 6). 结果显示,当使用5 μg/mL FucoPol-S或50 μg/mL岩藻多糖时,均能显著的提升细胞活力,其中FucoPol-S以更低质量浓度达到和岩藻多糖相当的保护作用. 据报道,细胞抗氧化能力与硫酸化多糖自由基清除活性高度相关[22],FucoPol-S在低质量浓度表现出细胞抗氧化活性可能与其较低的超氧阴离子半数抑制质量浓度有关. 同时注意到,当FucoPol-S质量浓度进一步增加时,细胞活力再度降低,这可能与高质量浓度抗氧化物质导致细胞中的负反馈调节有关.
2.1. 硫酸化修饰验证
2.2. 自由基清除活性
2.3. 细胞抗氧化实验结果
-
以Kosakonia sp. CCTCC M2018092菌株发酵产生的FucoPol为原料,采用氯磺酸-吡啶法进行硫酸化改性,制备了一种硫酸基含量为28.2%的硫酸化岩藻多糖,硫酸基团在各单糖单元的醇羟基上均有分布. 使用非选择性硫酸化方法,大多数硫酸根基团与多糖中空间位阻较小的C-6伯羟基相连,硫酸基接枝位置对生物活性也具有一定的影响[23]. 硫酸化修饰往往能增强多糖的的抗氧化活性[24],可能的机制是在多糖分子中引入硫酸基团引起O-H键的解离能减弱,增加硫酸化多糖的供氢能力[25].
硫酸化修饰增强了FucoPol-S的自由基清除活性. FucoPol-S较FucoPol ·OH清除率提升88.17%,·O2-清除率提升633.43%. 在实验浓度范围(0.062 5~2.00 mg/mL)内,FucoPol-S超氧阴离子清除活性均高于Fucoidan,且当质量浓度大于等于0.25 mg/mL时,其清除活性与阳性对照Vc相当. 硫酸化后FucoPol-S抗氧化活性得到增强,尤其在超氧阴离子清除方面具有媲美Vc的效果.
FucoPol-S对细胞氧化损伤具有保护作用. 在进一步的细胞抗氧化实验中,FucoPol-S显示出良好的细胞相容性,并能显著减少过氧化氢诱导的RAW 264.7细胞活力降低,且FucoPol-S能以低质量浓度(5 μg/mL)达到与高质量浓度岩藻多糖(50 μg/mL)相当的细胞抗氧化效果. 说明在低浓度下即可对细胞氧化损伤产生保护作用.
综上所述,以发酵法经硫酸化修饰的的FucoPol-S对比褐藻来源的Fucoidan在超氧阴离子自由基清除及低浓度细胞抗氧化方面具有明显优势,且原料具有廉价易得的优势,在未来抗氧化功能食品及保健制品开发中具有广泛应用前景.



 下载:
下载: