-
开放科学(资源服务)标识码(OSID):

-
枇杷(Eriobotrya japonica Lindl.)属于蔷薇科枇杷属, 是我国重要的亚热带常绿果树[1], 因其果实口感细腻多汁以及丰富的药用价值而深受人们喜爱, 目前已在世界范围内广泛栽培。近年来, 随着生物技术的迅速发展, 枇杷在基因组学[1]、生长发育[2]、抗逆性[3]、品质形成[4]等分子调控机制方面的研究发展迅速。然而, 高效遗传转化体系的缺乏限制了其基础研究的深入, 因此, 建立高效遗传转化、基因编辑平台成为亟待解决的问题。
原生质体是通过酶解等手段将细胞壁除去后, 所获得的游离球形活细胞, 包含了该生物的整套遗传信息, 能快速进行种群增长且具有同步性, 仍保留了其时空表达的特异性。近些年来, 原生质体逐渐成为基础研究的有力工具, 为作物基因分析[5]、遗传改良[6]、基因编辑[7]、单细胞测序[8]提供了新的方向。目前, 原生质体转化体系已被成功运用在拟南芥[9]、玉米[10]、小麦[11]、水稻[12]、柑橘[13]、苹果[14]和油菜[15]等多种作物上。然而, 不同物种中细胞壁的组成成分、渗透压等并不完全相同, 故不同物种甚至同一物种不同组织分离原生质体的方法可能差异大。因此, 高效原生质体体系的制备, 是利用原生质体进行遗传转化、基因分析、品种改良等研究的关键前提。
枇杷在原生质体方面的研究相对较少, 20世纪90年代, 林顺权等[16-17]在枇杷愈伤原生质体培养方面进行了一系列探索并成功获得再生植株, 但此后未见其他相关报道; 前期研究已建立了枇杷叶肉原生质体分离、纯化及瞬时转化体系[18]。然而, 枇杷叶片原生质体的制备体系易受组织状态、时期、环境等因素影响, 同时在冬末春初时期(12月至翌年2月)种子材料匮乏无法提供周年的试材, 低温叶片状态不佳导致原生质体分离效率极低, 成为枇杷叶片原生质体制备的限制。以幼嫩果肉和种子为试材的原生质体制备体系的建立, 可弥补此时期试材对原生质体制备的限制。
本研究以枇杷品种兴宁1号幼嫩果肉和种子为材料, 优化原生质体分离酶解液浓度、酶解时间及酶解条件, 建立了枇杷幼嫩果肉和种子原生质体的高效制备体系, 为利用枇杷原生质体瞬时表达系统进行亚细胞定位分析、基因互作、基因表达调控、基因编辑等研究奠定基础。
全文HTML
-
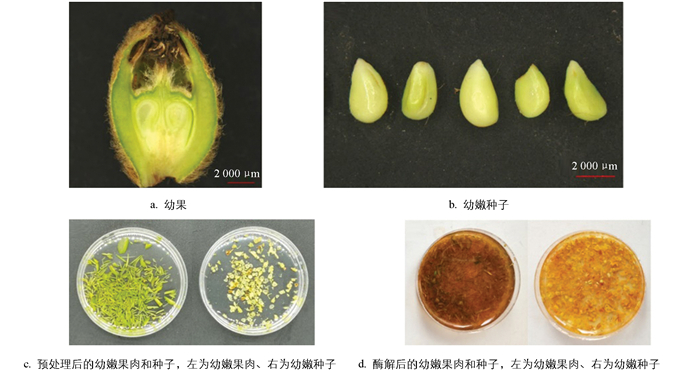
本试验以枇杷兴宁1号为试验材料, 于12月至翌年2月期间采集直径为0.5~1 cm的幼果, 置于冰盒, 立即带回实验室进行试验。供样品采集的枇杷植株栽植于西南大学实验教学基地(重庆市北碚区歇马镇)。
主要仪器: 正置荧光显微镜(Leica DM500B, 德国徕卡公司), 超纯水仪(ELGA, 法国威立雅集团), 激光共聚焦显微镜(Leica Sp8, 德国徕卡有限公司), 高速冷冻离心机(Himac CR22G, 日本Himac有限公司), 电子天平(千分之一)(JA2003, 上海精天电子仪器有限公司)。
-
将收集的枇杷兴宁1号的幼果, 在冰水中轻轻去除果实表面的绒毛, 确保不刮伤果皮。幼嫩果肉处理: 为减少褐变, 全过程用纯净水浸润果肉, 取果肉1 g(约5个幼果), 用锋利的刀片将果肉切成约0.5 mm宽的条状碎块, 迅速用镊子转入装有0.8 mol/L高渗甘露醇溶液的培养皿中预处理(图 1a, c)。幼嫩种子处理: 将幼果中取出的种子称取0.5 g(约10个幼果的种子), 切成约0.5 mm厚的薄片, 全过程用纯净水浸润薄片, 迅速地将其用镊子转入装有高渗溶液的培养皿中预处理(图 1b, c)。将盛有高渗溶液和切好材料的培养皿置于摇床上, 25 ℃条件下50 r/min黑暗处理2~3 h。
-
试验酶解所用酶解液由纤维素酶RS(Cellulose RS)、离析酶R-10(Macerozyme R-10)、0.6 mol/L甘露醇、0.01 mol/L MES、0.1% BSA、0.01 mol/L CaCl2组成(pH值为5.8)。此步骤的操作流程为: 预处理完成后, 吸干高渗甘露醇溶液, 迅速向培养皿内加入提前配制好的酶解液5 mL(现用现配)。轻轻晃动培养皿, 使酶解液和材料充分混合均匀, 然后将其密封。将培养皿置于温度为25 ℃的恒温摇床中, 黑暗条件下进行酶解。
酶解参数通过单一变量法进行优化, 以获得最佳酶解方案。设置4.0% (w/v)、4.4% (w/v)、4.6% (w/v)、4.8% (w/v)、5.4% (w/v)共5个纤维素酶浓度, 与3.4% (w/v)的离析酶组成酶解组合, 在25 ℃下、摇床转速50 r/min, 黑暗中酶解11 h后统计数据; 设置2.6% (w/v)、3.0% (w/v)、3.4% (w/v)、3.8% (w/v)共4个离析酶R-10浓度, 与4.8% (w/v)纤维素酶组成酶解组合, 在25 ℃下、摇床转速50 r/min黑暗中酶解11 h后统计数据。
-
在纤维素酶RS浓度4.8% (w/v)、离析酶R-10浓度3.4% (w/v)酶解液组合下, 于25 ℃、摇床转速50 r/min黑暗条件下, 分别酶解4 h、7 h、10 h、11 h、11.5 h、12 h、13 h、15 h、18 h后进行数据统计。同时, 还对酶解过程中摇床转速进行了优化, 设置0 r/min、30 r/min、50 r/min、90 r/min共4个转速梯度。
-
酶解完成时(图 1d), 将培养皿中加入5 mL W5(154 mmol/L NaCl, 125 mmol/L CaCl2, 5 mmol/L KCl, 2 mmol/L MES, pH值5.8)溶液轻柔混合均匀以终止酶解反应, 之后将混合液用巴氏吸管轻轻吸出, 通过300目的细胞筛过滤, 去除组织碎片和杂质后, 将经筛网过滤后的混合液转入15 mL离心管中, 在室温条件下700 r/min离心10 min, 离心完成后轻轻吸去上层液体, 加入1 mL W5溶液, 轻轻地用巴氏吸管吹打离心管底部的原生质体沉淀, 使原生质体与W5溶液混合均匀, 用于计数。
-
将均匀悬浮在W5溶液中的原生质体, 用血细胞计数板进行计数获取原生质体数量。在血细胞计数板中央滴上充分混合均匀的原生质体悬浮液, 盖上盖玻片后置于光学显微镜下观察计数; 随机抽样5个中方格中的原生质体数目, 每个样本连续统计至少3次, 取其平均数记录。按照以下公式计算原生质体产量:
原生质体产量(个/g)=5个方格内原生质体总数/5×25×10×1 000×W5体积/酶解材料的质量。
采用荧光素双醋酸酯(FDA)染色法来测定原生质体的活力率。原生质体悬浮液与FDA染色液(用丙酮配制5 mg/mL)体积比为10∶1, 即在载玻片上滴700 μL原生质体悬浮液与70 μL FDA染色液混合均匀, 置于黑暗环境中染色5 min后, 在荧光显微镜下观察并统计活力率。在明场视野下观察计数原生质体总量, 在暗场激发光下统计发出绿色荧光的原生质体数量。活力率的公式如下:
每个样品百分率计算3次, 取其平均值作为该样本的最终活力数据。
-
每组试验进行3~5次生物学重复, 试验结果以平均值±标准差(x±s)表示, 试验数据通过SPSS V19.0软件进行所有数据的方差分析与多重比较, 多组间比较采用单因素方差分析, 以最Duncan检验法(p<0.05)评价揭示不同处理之间的差异显著性。
1.1. 试材与主要仪器
1.2. 材料预处理
1.3. 原生质体分离酶解组合筛选
1.4. 酶解条件和酶解时间筛选
1.5. 原生质体收集
1.6. 原生质体计数与活力率测定
1.7. 数据统计分析
-
在酶解过程中, 摇床的强度(转速)也能影响原生质体制备的效果, 强度过高, 易对原生质体造成损伤; 强度过低, 导致原生质体无法释放。通过控制单一变量法, 探索不同摇床强度对原生质体产量的影响(表 1), 结果显示, 当摇床转速为90 r/min时, 原生质体产量显著高于转速处于0 r/min、30 r/min, 与转速50 r/min处理相比, 结果不存在显著性差异。由于在试验过程中90 r/min转速的原生质体收集溶液, 杂质明显较多, 因此, 认为在原生质体分离过程中, 较佳的摇床转速为50 r/min。
-
酶解时间是原生质体分离的关键影响因子之一, 如果酶解时间太短, 细胞壁未被完全分解, 原生质体无法呈现均匀的形态, 细胞边缘不光滑; 酶解时间过长, 酶液的毒害作用易造成细胞破裂, 视野内细胞碎片杂质多。因此, 本研究分别对幼嫩果肉及种子的酶解时间进行了4 h、7 h、10 h、11 h、11.5 h、12 h、13 h、15 h和18 h筛选。
如表 2所示, 通过枇杷幼果酶解产量和活力率统计, 当酶解时间在10~11.5 h时, 原生质体的活力率相对稳定, 10 h、11 h和11.5 h 3个时间处理结果差异不显著, 其中在11 h时活力最佳, 时间低于10 h或高于11.5 h时, 原生质体活力率不稳定, 且总体呈下降趋势。酶解时间为10 h和12 h时, 与酶解时间为11 h和11.5 h相比, 原生质体产量差异不显著, 但显著高于酶解时间为4 h、7 h、13 h和18 h的结果。
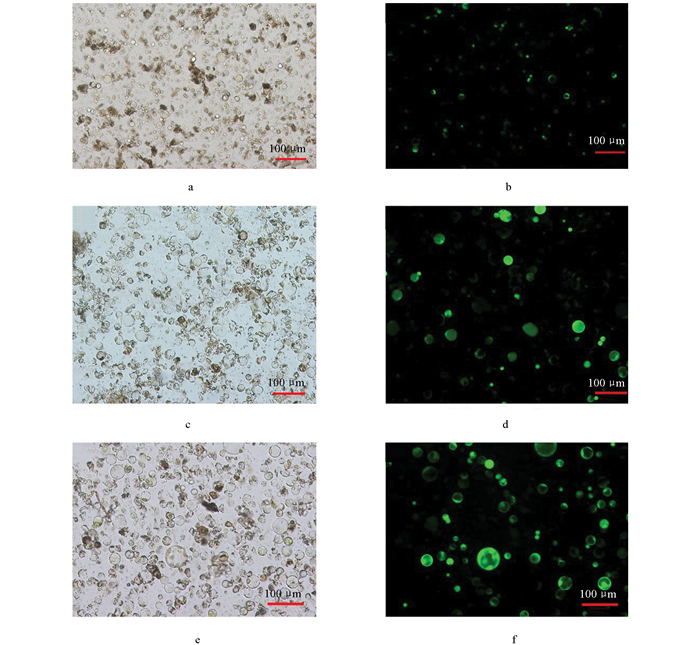
同时, 不同酶解时间条件下, 分离的原生质体状态差异较大(图 2), 在4 h条件下, 分离出来的原生质体形态较好, 视野中杂质碎片少, 但原生质体总量相对较少(图 2a); 酶解时间为12 h和15 h时分离的原生质体总量较大, 也能够明显观察到杂质碎片存在(图 2b、c); 当酶解时间到达18 h时, 分离出的原生质体变形严重(图 2d)。结合数据及形态观察得出, 枇杷幼果原生质体分离酶解时间为11 h较为合适。
对枇杷幼嫩种子不同酶解时间处理结果如表 3所示。枇杷幼嫩种子酶解10 h时与其他处理时间相比, 其原生质体产量显著最高, 且原生质体形态均匀光滑, 杂质较少; 酶解时间11 h、11.5 h和12 h之间差异不显著; 酶解时间为11 h和11.5 h与4 h、13 h、15 h和18 h, 原生质体产量差异不显著。说明枇杷幼嫩种子原生质体分离过程, 随着酶解时间的增加, 产量有增加的趋势, 在酶解10 h时产量达到最高, 随后随着时间的增加, 产量开始下降, 其产量下降原因可能是酶解离析出的原生质体受到酶解液毒害导致破裂。活力率的多重比较结果则显示, 酶解12 h时原生质体的活力率最佳, 与15 h和18 h时存在显著差异, 其余各组之间差异不显著, 表明酶解液长期对原生质体的毒害作用, 会降低原生质体的活力。综合比较原生质体产量和活力率, 考虑到原生质体形态和杂质等因素, 认为幼嫩种子酶解10 h效果最佳。
-
前期从枇杷叶片原生质体分离过程可知, 纤维素酶RS和离析酶R-10组合酶解液对枇杷原生质体分离效果较好[18], 因此, 枇杷幼嫩果肉和种子原生质体分离酶解液采取此两种酶进行。通过单一变量原则, 对枇杷幼嫩果肉和种子设置纤维素酶RS 4.0%、4.4%、4.6%、4.8%、5.4%共5个浓度梯度, 分别与浓度为3.4%的离析酶R-10组合。
枇杷幼嫩果肉不同纤维素酶RS浓度处理结果显示, 随着纤维素酶RS浓度的增加, 枇杷幼嫩果肉原生质体的产量呈现先增加后减少的趋势(表 4)。当纤维素酶RS浓度为4.8%时原生质体的产量最高, 但与纤维素酶RS浓度为4.4%、4.6%和5.4%时的原生质体产量相比, 不存在显著差异, 但显著高于纤维素RS浓度为4.0%时的原生质体产量。活力率分析结果显示, 各处理之间活力率差异不显著, 但纤维素酶RS浓度为4.4%和4.6%酶解的原生质体活力率最高。说明纤维素酶RS浓度的增加会增强酶液的毒害作用, 从而降低枇杷幼嫩果肉原生质体活性。因此, 枇杷幼嫩果肉最佳的纤维素酶RS浓度应为4.6%, 在此浓度下原生质体有较高的产量和活性。
不同纤维素酶RS浓度对枇杷幼嫩种子原生质体分离的影响结果如表 5所示, 随着纤维素酶RS浓度的增加, 其原生质体产量呈先增加后减少的趋势。当纤维素酶RS浓度为4.4%时, 其原生质体产量显著高于其余各组。当纤维素酶RS浓度为4.0%和4.4%时, 分离得到的原生质体活力率可达90%, 并且显著高于其余3组, 其趋势与幼嫩果肉结果一致。结果表明, 纤维素酶浓度为4.4%时分离枇杷幼嫩种子, 获得的原生质体的产量和活力率上均表现为显著优异, 平均产量可达7.583±1.377×105个/g, 活性率可达到90%以上。
-
采用单一变量原则, 对枇杷幼嫩果肉和幼嫩种子原生质体分离酶解液离析酶R-10浓度设置2.6%、3.0%、3.2%、3.8%共4个浓度梯度, 分别与4.8%的纤维素酶RS组合, 结果如表 6和表 7所示。当离析酶R-10浓度为2.6%时, 枇杷幼嫩果肉的原生质体产量最高, 但与浓度为3.0%和3.2%时处理差异不显著。当离析酶R-10浓度为3.0%和3.2%时, 枇杷幼嫩果肉的原生质体活力率差异不显著, 但二者与浓度为2.6%和3.8%时的活力率差异显著(表 6)。由此可见, 随着离析酶浓度的增加, 枇杷幼嫩果肉原生质体产量有所下降, 但依旧保持在较高水平, 原生质体活性呈现先增加后减少的趋势, 因此, 枇杷幼嫩果肉原生质体分离的较佳离析酶R-10浓度为2.6%, 其原生质体活性也相对较高。
不同离析酶R-10浓度对枇杷幼嫩种子原生质体分析结果表明, 当离析酶浓度为2.6%时枇杷幼嫩种子原生质体产量最高; 离析酶R-10浓度为2.6%、3.2%和3.8%时, 3组处理原生质体产量差异不显著, 但其产量均显著高于离析酶R-10浓度为3.0%时。离析酶R-10浓度在2.6%与3.0%时, 分离获得的原生质体活力率差异不显著, 但显著高于浓度为3.2%和3.8%时, 说明离析酶浓度为2.6%和3.0%时枇杷幼嫩种子的原生质体活力最佳; 并且随着离析酶浓度的增加, 枇杷幼嫩种子分离得到的原生质体产量和活性率都呈下降的趋势, 由此可见, 当离析酶R-10浓度为2.6%时, 不论产量还是活力率都为最佳, 产量可达7.417×105个/g, 活力率可达79.85%。
枇杷幼嫩种子和幼嫩果肉原生质体分离效果如图 3所示, 由图可知, 枇杷幼嫩果肉分离出的原生质体体积大, 能够观察到中央大液泡和叶绿素; 枇杷幼嫩种子分离出的原生质体体积小, 可观察到细胞中含有反光的内含物, 无叶绿素和中央大液泡。
2.1. 酶解过程摇床强度对原生质体产量的影响
2.2. 酶解时间对枇杷原生质体分离的影响
2.3. 纤维素酶浓度对枇杷原生质体分离的影响
2.4. 不同离析酶浓度对枇杷原生质体分离的影响
-
枇杷作为重要的特色经济果树, 其原生质体的高效制备, 是今后进行亚细胞定位、蛋白互作、单细胞测序、基因编辑等研究的基础。
由于植物细胞、组织和器官固有的异质性, 不同来源材料的原生质体分离效率存在显著差异。研究表明, 幼嫩组织因其薄壁细胞丰富、细胞壁降解效率高等优势, 已成为原生质体分离的首选材料体系, 如拟南芥[9]、玉米、小麦、水稻[19]等模式植物通过幼嫩叶片分离原生质体。此外, 根、茎、悬浮愈伤组织等也广泛应用于原生质体操作[20]。近年来, 非传统材料的应用拓展了原生质体分离的技术边界, 利用菊花和油茶花瓣建立了原生质体转化体系[21-22]花粉诱导萌发后的花粉管也能进行原生质体分离[23-24]。同时, 特定组织来源的原生质体具有功能特异性, 如八仙花萼片原生质体为研究pH值调控液泡着色机制提供了理想模型[25], 梨花粉原生质体进行基因组测序解决了基因组杂合造成的序列嵌合问题[23]。本试验选用枇杷幼嫩果肉和种子作为分离材料, 通过体系优化获得高活性原生质体, 在最佳分离条件下, 幼嫩果肉获得的原生质体数量高于幼嫩种子, 但其最高活力明显低于幼嫩种子, 且两种原生质体均达到应用于PEG介导的瞬时转化及细胞融合等后续研究的要求。该材料体系取材时期(12月至翌年2月)恰与枇杷种子缺乏期、叶片生理状态不适宜原生质体分离的时期重合, 有效解决了试验材料季节性短缺的技术瓶颈, 此时序互补策略完善了枇杷周年原生质体研究体系。
植物细胞壁主要由纤维素、果胶、半纤维素及木质素等多糖网络构成[26], 其组分比例与空间排布具有显著的物种特异性和组织异质性。因此, 植物原生质体分离酶种类主要有纤维素酶、果胶酶、半纤维素酶、崩溃酶、离析酶、蜗牛酶等。拟南芥[27]、小麦[28]、玉米[10]、水稻[12]、葡萄[29]、核桃[30]等原生质体分离使用纤维素酶和离析酶组合, 柑橘[31]、芹菜[32]、杨树[33]等原生质体分离使用纤维素酶和果胶酶组合较为常见, 油茶原生质体分离在纤维素酶和离析酶的基础上加入蜗牛酶效果更好[34], 柳枝稷则是在纤维素酶和离析酶的基础上配合崩溃酶和半纤维素酶[35]。本试验发现, 将纤维素酶加离析酶的组合用于枇杷原生质体分离可以达到较好的效果, 其中纤维素酶用于分解植物细胞壁的主要成分纤维素, 而离析酶则可以使细胞壁之间相互分离, 从而使得原生质体从细胞团中分离出来。此前对枇杷叶肉原生质体分离过程优化结果显示, 其叶片原生质体分离的最适酶浓度为5.0% (w/v)纤维素酶RS+3.4% (w/v)离析酶R-10, 本研究结果表明幼嫩果肉制备原生质体的最佳酶解组合为4.6% (w/v)纤维素酶RS+2.6% (w/v)离析酶R-10; 幼嫩种子制备原生质体的最佳酶解组合为4.4% (w/v)纤维素酶RS+2.6% (w/v)离析酶R-10, 这表明即使相同物种, 不同组织原生质体制备条件下其酶解最适浓度仍存在明显差异。
酶解时间也是影响原生质体分离效果重要的因素之一。酶解时间过短, 细胞壁酶解不完全导致原生质体释放数量不足; 酶解时间过长, 酶对细胞壁作用太彻底, 原生质体释放充足, 但对细胞活性伤害大, 原生质体破碎严重[36]。植物原生质体分离酶解过程时间差异较大, 一般为4~24 h, 分离材料的状态、抽真空等处理都会影响酶解时间。孙鹤等[19]的报道表明, 玉米和水稻叶肉原生质体在纤维素酶和离析酶组合分离过程的时间为7 h, 而小麦则为5 h。木本作物葡萄悬浮细胞在适合浓度的纤维素酶R-10和离析酶R-10酶解液组合下只需要4 h就能够获得产量和活力俱佳的原生质体[29], 梨叶片在果胶酶和离析酶作用下酶解12 h效果较好[37]。在本研究中, 枇杷在不同材料和酶解组合下, 最佳酶解时间为10~12 h, 酶解时间过短或过长, 都会影响枇杷原生质体的产量及活性。当酶解时间超过15 h后, 其原生质体产量会明显下降, 表明酶解时间过长, 酶对细胞的伤害作用累积较强, 最后造成原生质体的活力下降甚至破裂。
-
幼嫩果肉制备原生质体的最优酶解组合为4.6%纤维素酶RS和2.6%离析酶R-10, 0.6 mol/L甘露醇维持渗透压, pH值5.8, 25 ℃条件下, 黑暗酶解11 h后, 离心机转速为50 r/min收集原生质体, 其数量可以达到1.66×105个/g, 活力率为62.29%; 幼嫩种子制备原生质体的最优酶解组合为4.4%纤维素酶RS和2.6%离析酶R-10, 0.6 mol/L甘露醇维持渗透压, pH值5.8, 25 ℃条件下, 黑暗酶解10 h, 离心机转速为50 r/min收集原生质体, 其数量可以达到7.583×105个/g, 活力率为90.83%。



 下载:
下载: