-
脂肪酶成熟因子1蛋白(Lipase maturation factor 1, LMF1), 是在脂肪酶成熟过程中发挥重要作用的一种内质网膜蛋白[1], 在高等动物的大部分组织中均表达, 对动物体脂肪代谢、能量平衡具有非常重要的调节作用, 是机体脂质代谢和血脂稳态调控网络的重要调节因子[2-3].研究表明, LMF1基因作为内质网上的分子伴侣参与了脂蛋白脂酶(LPL)、肝脂酶(HL)和内皮脂肪酶(EL)几种血管酯酶的翻译后成熟和催化活化[4], 且LMF1基因的突变或缺失会导致人和动物体联合缺乏症(combined lipase deficiency, CLD), 进而诱发严重的高甘油三酯血症, 是肥胖、糖尿病和各种心血管疾病的主要发病原因[5-7].然而, 目前关于LMF1的研究, 主要集中在人类和小鼠脂质代谢紊乱引起的相关疾病方面, 而对猪、马、牛、羊等大家畜上报道相对较少.鉴于LMF1基因在脂质代谢中的重要作用, 因此可考虑将该基因作为畜禽生产性状的候选基因来进行研究.
从江香猪作为著名的脂肪型小型猪, 具有体型小、基因纯合等特点, 是进一步研究机体脂质代谢紊乱导致人类各种疾病最为理想的模式动物之一.猪的LMF1基因定位于3号染色体上, 全长3 258 bp, 由8个外显子和7个内含子构成, 其CDS区全长996 bp, 编码332个AA.本文以从江香猪为研究对象, 克隆分析LMF1基因, 研究从江香猪LMF1基因与其他猪种基因的差异, 并通过细胞转染和荧光共定位的技术手段, 验证LMF1基因在细胞中的亚细胞定位情况, 建立猪LMF1基因在猪上的基础数据.相关研究结果将为进一步研究LMF1蛋白与LPL, HL和EL几种血管酯酶在脂质代谢的作用机理方面奠定基础.
HTML
-
JM109感受态细胞, pMD-19-T载体(Takara公司); pEGFP-C1载体, 293T细胞由贵州大学高原山地动物遗传育种与繁殖教育部重点实验室段志强博士惠赠.
-
RNA提取试剂盒(Omega), 反转录试剂盒(康为); 2×Es Taq Master Mix(康为), 限制性内切酶Xho I, BamH I及T4 DNA ligase (Takara); 质粒抽提试剂盒, 琼脂糖凝胶回收试剂盒(Axygen), 无内毒素质粒提取试剂盒, QuantFastTM SYBR® Green PCR Kit(QIAGEN), FuGENE® HD Transfection Reagent转染试剂(Roche); DL5000, DL15000 Marker (Takara); DMEM培养基, 优质胎牛血清, Opti-MEM培养基®(gibco); 倒置荧光显微操作系统(Nikon).
1.1. 菌株、载体及细胞
1.2. 试剂和仪器
-
根据GenBank中猪LMF1(登录XM_013995772.1) mRNA序列, 采用primer Premier 5.0软件设计基因克隆引物和荧光定量引物, 以GAPDH作为内参基因, 并在克隆引物上、下游分别引入Xho I, BamH I酶切位点, 设计好的引物送上海英俊生物技术有限公司合成.引物序列见表 1.
-
取从江香猪背最长肌50~100 mg, 加入液氮并研磨成粉, 按照Omega RNA提取试剂盒使用说明书进行总RNA的提取, 参照康为公司反转录试剂盒说明进行逆转录, 获得的cDNA产物可直接用于PCR反应和荧光定量PCR反应.采用LMF1-F和LMF1-R两引物, 设53 ℃, 55 ℃, 56 ℃, 57 ℃, 58 ℃, 60 ℃ 6个退火温度, 扩增LMF1目的基因.
-
根据宝生物公司pMD-19-T载体说明, 链接目的片段和T载体, 然后转化至大肠杆菌JM109感受态细胞中, 进行蓝白斑删选, 挑取阳性菌落进行LB液体培养基培养, 12 h后进行菌液PCR鉴定.根据菌液PCR结果提取质粒, 进行双酶切鉴定.对菌液PCR鉴定和双酶切鉴定均正确的质粒, 送上海英俊生物技术有限公司进行测序鉴定.
-
根据测序结果, 采用STRING数据库在线系统(http://string-db.org/)分析与LMF1相互作用的蛋白.同时运用PSORT Ⅱ Prediction程序分析LMF1蛋白氨基酸序列, 对蛋白进行亚细胞定位.
-
采用Xho I, BamHⅠ限制性内切酶分别酶切pMD-19-LMF1和pEGFP-C1两质粒, 经1%琼脂糖凝胶电泳分离后, 切胶回收目的片段. T4 DNA ligase 16 ℃过夜定向连接胶回收后的pEGFP-C1与LMF1目的片段.采用含有卡那霉素的LB琼脂平板删选阳性菌落, 进一步构建pEGFP-C1-LMF1真核表达载体, 方法同2.2.2.
-
本实验采用24孔细胞培养板转染, 待细胞达到90%丰度时开始转染.以pEGFP-C1空载体为对照组, pEGFP-C1-LMF1为实验组, 具体转染步骤参照FuGENE® HD Transfection Reagent的操作说明书进行, 转染结束后将培养板置于37 ℃, 5% CO2的培养箱中培养.转染24 h后进行荧光共定位实验.首先, PBS浸洗细胞培养孔3次, 4%多聚甲醛固定细胞20 min; 然后用0.25% Triton X-100室温通透5 min(注:后续实验步骤尽量在暗处进行); 最后滴加DAPI避光孵育5 min, 再在荧光显微镜下采集图像, 并采用PhotoshopCS3软件分析融合蛋白的亚细胞定位.
-
Trizol法提取从江香猪心、肝、脾、肺、肾、大肠、小肠、脂肪、背最长肌、胃10个器官组织的总RNA, 稀释至同一浓度.以GAPDH基因作为内参, 参照QuantFastTM SYBR® Green PCR试剂盒说明书进行荧光定量PCR, 每个样品设3个重复.反应体系为10 μL:PCR Mix 6 μL, 上下游引物(10 μmol/L)各0.4 μL, cDNA 2 μL, ddH2O 1.2 μL; 反应程序:95 ℃ 5 min, (95 ℃ 10 s, 58 ℃ 30 s, 65 ℃ 0.05 s)×40个循环, 95 ℃ 0.5 s.
2.1. 引物设计
2.2. LMF1基因的克隆与序列分析
2.2.1. RNA的提取和LMF1基因的获得
2.2.2. pMD-19-LMF1亚克隆载体的构建
2.2.3. LMF1基因的生物信息学分析
2.3. pEGFP-C1-LMF1真核表达载体的构建
2.4. pEGFP-C1-LMF1真核表达载体在293T细胞中的表达及亚细胞定位
2.5. LMF1基因在从江香猪不同组织的表达分析
-
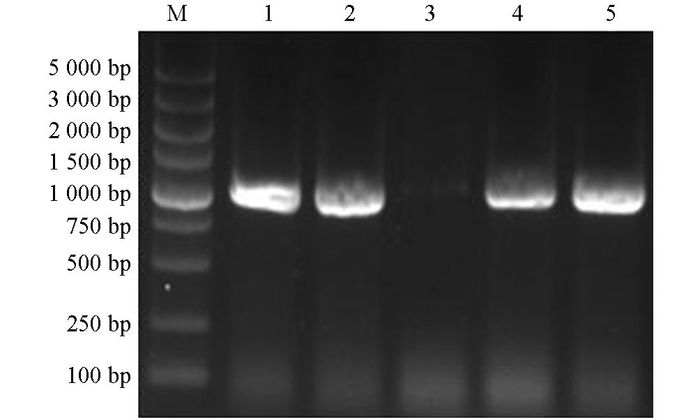
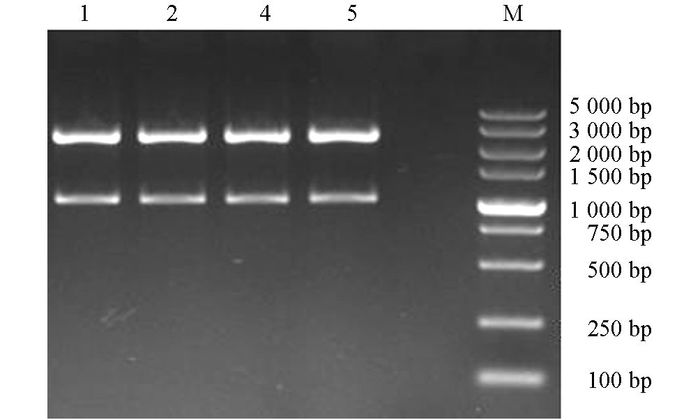
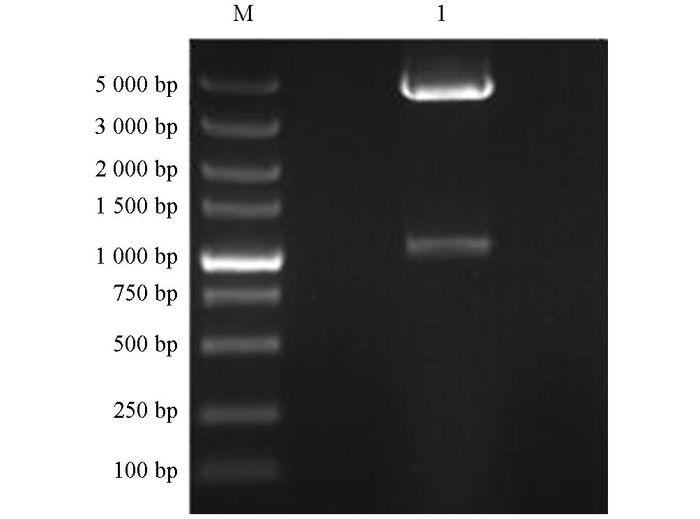
对挑取的阳性克隆子, 进行菌液PCR鉴定, 琼脂糖凝胶电泳显示, 1, 2, 4, 5泳道在1 047 bp左右出现目的条带, 见图 1; 提取1, 2, 4, 5泳道对应菌株的质粒DNA, 采用Xho I, BamHⅠ进行双酶切鉴定, 结果见图 2, 4株菌结果均在1 047 bp和2 692 bp处出现两条亮带, 表明1, 2, 4, 5号泳道对应的菌株已成功将目的基因克隆进载体pMD19-T载体中.
-
采用DNAstar生物分析软件中的序列比对软件MegAlign对测序得到的从江香猪LMF1基因编码序列与GenBank发表的其他猪种的LMF1基因cDNA序列进行同源性比较, 结果发现从江香猪LMF1 cDNA序列与GenBank上发表的野猪LMF1基因cDNA序列同源性达到了100%.
-
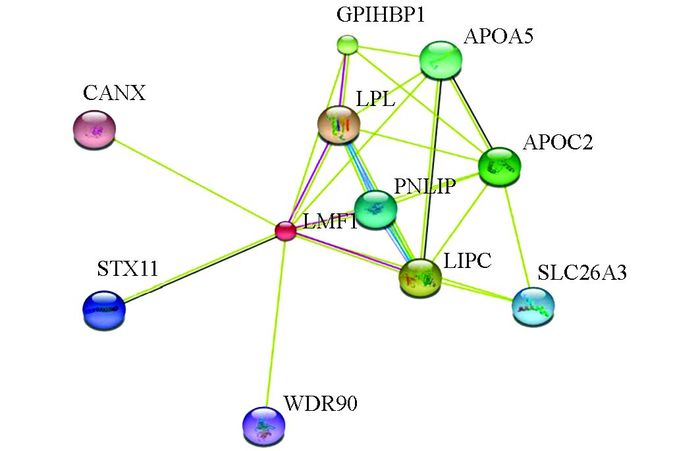
通过STRING蛋白质相互作用分析软件分析, 结果表明, LMF1基因与脂蛋白脂酶(LPL)、马胰腺甘油三酯脂酶(PNLIP)、肝脂肪酶(LIPC)、(钙联接蛋白)CANX、(突触融合蛋白11) STX11等(标识要一致)10种蛋白具有蛋白质间的相互作用, 如图 3.
-
PSORT Ⅱ Prediction对LMF1蛋白的亚细胞定位分析表明, LMF1蛋白主要集中在细胞质中表达, 其中质膜占43.6%, 内质网占30.4%, 液泡中占17.4%, 高尔基体占4.3%, 线粒体占4.3%.
-
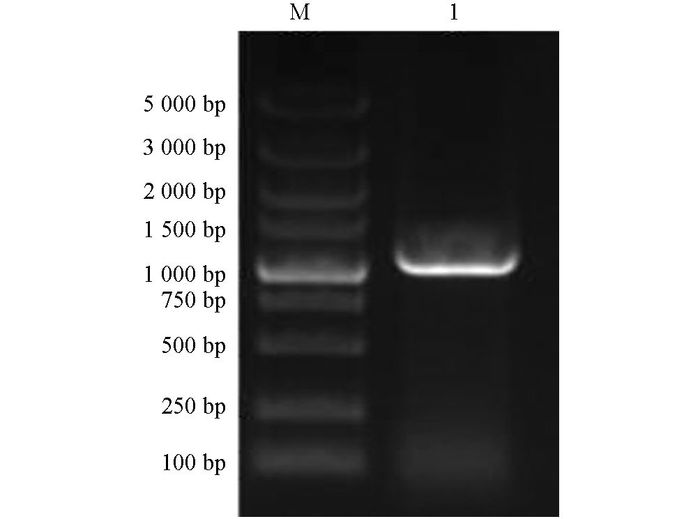
提取阳性菌体质粒DNA, 经PCR鉴定和双酶切鉴定结果均正确, 分别见图 4和图 5, 说明携带有绿色荧光蛋白的pEGFP-C1-LMF1重组真核表达载体构建成功, 并已成功地导入大肠杆菌JM109中.
-
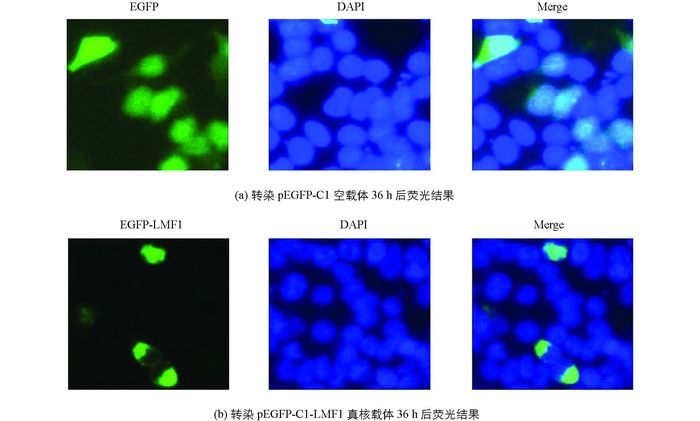
通过DAPI染核及荧光共定位发现, LMF1蛋白与对照组EGFP蛋白相比, 主要集中在细胞质中表达, 见图 6.
-
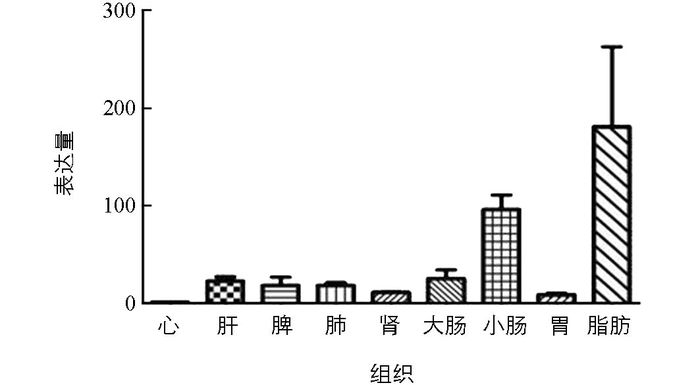
经SPSS17, GraphPad Prism 5两个生物统计软件的分析, 结果见图 7.由图 7可见, LMF1基因在从江香猪9个组织中的表达量由高到低为脂肪, 小肠, 大肠, 肝, 肺, 脾, 肾, 胃, 心, 其中脂肪与小肠与其他7个组织相比, 表达量存在统计学意义(p < 0.01);同时, 脂肪与小肠相比, 表达量也存在统计学意义(p < 0.01).结果与LMF1基因在调节动物体脂肪代谢、能量平衡、参与机体脂质代谢和血脂稳态调控网络的重要调节因子等方面的生理机能相一致.
3.1. pMD-19-LMF1亚克隆载体鉴定结果
3.2. 生物信息学分析结果
3.2.1. 序列比对结果
3.2.2. 与LMF1相互作用的蛋白
3.2.3. LMF1蛋白的亚细胞定位预测
3.3. pEGFP-C1-LMF1重组质粒鉴定
3.4. 荧光共定位检测LMF1基因在细胞中的定位
3.5. LMF1基因在从江香猪不同组织的表达
-
LMF1基因作为机体脂质代谢和血脂稳态调控网络的重要调节因子, 其作为内质网上的分子伴侣在运输脂蛋白脂酶(LPL)到活性位置和对肝脂酶(HL或LIPC)翻译后修饰中起到调节脂质代谢的作用[8], 然而此过程中哪些蛋白与LMF1共同完成了调节脂质代谢的生理作用尚不清楚.论文采用STRING蛋白质相互作用分析软件, 发现LPL, APOC2, GPIHBP1, PNLIP, LIPC, CANX, STX11, APOA5, WDR90, SLC26A3 10种蛋白与LMF1存在相互作用.此外, 研究表明患者体内LMF1及LPL, APOC2, APOA5, GPIHBP1等与其存在互作基因的突变, 会导致严重的高甘油三脂血症(HTG)[9-11], 然而其发病机制和作用机理并不清楚.目前对LMF1蛋白的研究发现, LMF1作为跨膜蛋白在把LPL运送到活性位置的过程中起作用, LPL作为体内脂质和脂蛋白代谢的关键酶, 其主要功能是催化水解CM与VLDL中的甘油三脂(TG), 向组织提供产能所需的游离脂肪酸[12]. LPL上拥有APOC2的结合和活化位点, 其在LMF1的运输作用下, 通过GPIHBP1定位在毛细血管内皮细胞的表面, 进一步将血液中的TG水解成游离的脂肪酸和甘油[13].然而其他与LMF1存在相互的蛋白在脂质代谢过程中的作用及其机制还尚不清楚, 需开展进一步的实验研究.
此外研究表明, LMF1作为一种跨膜蛋白, 以内质网上分子伴侣的形式参与了LPL, HL, EL等酯酶的翻译后修饰, 说明该蛋白主要集中在质膜和内质网中表达, 论文通过荧光共定位和PSORT Ⅱ Prediction亚细胞定位软件进一步获得了验证, 表明LMF1蛋白主要集中在细胞质中表达, 其中质膜占43.6%, 内质网占30.4%.实时荧光定量PCR结果表明, LMF1基因在从江香猪9个组织均有表达, 且在脂肪和小肠中表达量最高, 达统计学意义, 在心脏中最低, 这一结果与LMF1基因在参与机体脂质代谢和血脂稳态调控网络等方面的生理机能相一致, 相关结果也暗示, 可将LMF1基因作为筛选畜禽相关生产性状的重要候选基因进行研究.






 DownLoad:
DownLoad: