-
开放科学(资源服务)标志码(OSID):

-
随着经济水平发展与人类活动加剧,水体富营养化已逐渐成为全球迫在眉睫的环境问题[1]. 水体富营养化过程中,藻类等浮游植物的过度繁殖导致水体透明度下降,溶解氧降低,进而使得水质恶化[2],且部分藻类产生的有害次生代谢物严重威胁着人类健康[3]. 富营养化水体中藻类的生长与营养盐[4]、光照[5]、温度[6]、pH[7]、水动力[8]等因素有关.
已有研究表明,人类活动释放到水体中的氮磷营养盐是导致藻类快速生长甚至形成水华的根本原因[9]. 为制定基于营养盐控制的水华防控策略,国内外许多学者均采用营养盐添加实验确定藻类生长的关键营养盐种类(即浮游植物快速生长的限制因子)[10],并得到浮游植物生长的营养盐阈值[11]. 目前关于氮和磷在藻类生长过程中的主导作用还存在一定争议,主要包括:磷(P)限制学说,如经典湖沼学认为P是淡水湖泊富营养化最主要的限制因子[12];氮(N)限制学说,如Howarth等[13]研究发现近海富营养化系统中主要存在N限制;氮磷比(N/P)限制学说,如Smith[14]针对全球17个湖泊的研究发现当氮磷比小于29(质量比)时蓝藻占优势. 不同的研究表明,针对不同地区湖泊和河流的浮游植物生长限制因子研究常得到不同的结论[15-16].
三峡工程是中国在长江流域重要的水利工程[17],其周期性“畜清排浊”的运行影响了库区内30余条一级支流的水动力条件和营养盐负荷[18],并且部分支流水华频发[19-20],因此控制入库支流浮游植物过度生长对保障支流及长江干流水质和水生态健康具有重要意义. 已有学者对三峡库区不同支流的浮游植物生长进行了研究,如有研究表明蓄水后水库支流香溪河的局部水域总氮(TN)降低,总磷(TP)上升至0.18~1.30 mg/L时,藻类群落结构发生变化,细胞密度增加92.6%[21];也有研究发现支流大宁河中藻细胞密度与TN,硝态氮(NO3--N)呈显著负相关,发现N是影响浮游植物生长的关键因子[20]. 御临河是三峡水库库尾汇入库区的重要一级支流,相较于其余支流,御临河流域包含两个国家级经济开发区,流域内高强度的城市建设导致城市污水和农业面源污染逐渐加重[22];由于御临河地势相对较高且支流回水区长度较短,蓄水期(高水位,175 m)受回水顶托的影响较库首支流弱,回水区水体滞留时间亦相应较短. 在泄水期(低水位,145 m)运行期,库尾支流与库首支流呈现类似的河流特征[23]. 上述区域特征及水动力条件响应使得御临河营养因子、水生态因子、环境因子及水文水动力条件等呈现出与库首支流不同的时空动态特征. 因此,本文以御临河为研究对象,通过原位营养盐添加实验,解析了御临河富营养化的主要限制因子与浮游植物的生长阈值. 研究结果有望为长江上游城镇化区域支流的富营养化控制提供理论依据.
HTML
-
御临河介于东经106°27′30″~106°57′58″,北纬29°34′45″~30°07′22″之间,全长208.4 km,流域面积3 861 km2,重庆市内流域面积772.8 km2,多年平均流量50.72 m3/s,常年平均气温17.3 ℃,常年平均降雨量约1 100 mm,平均日照约1 340 h. 自2003年三峡大坝蓄水以来,御临河水位呈现周期性变化,即冬季高水位(蓄水期),夏季低水位(泄水期)[24],进而随蓄、泄水交替过程呈现湖泊型与河流型之间的形态转换.
-
于2019年8月(泄水期)在御临河河口处进行,取1 L河水于1 L塑料透明水样瓶中,所有水样瓶悬挂于停靠在河面上的船体外,使其敞口并漂浮于水面上,以保证实验体系充分暴露于实际水温、光照以及风浪扰动等环境因素下. 营养盐添加方案见表 1,每组设3个平行,其中,N以KNO3添加,P以K2HPO4添加. 为避免浮游植物在生长过程中缺乏碳元素,在处理中加入NaHCO3,使每个处理中碳元素的浓度为560 μmol/L[25].
-
实验共进行6 d,分别在第0,3,6 d采集水样进行测定,每次取样前搅拌实验体系,以保证每次取样均匀. 对于本研究采用的悬瓶营养盐添加实验方法,实验培养时间一般选择在1周内以探究浮游植物对营养盐浓度变化的即时反应[26],尽可能避免体系中其他微量元素被消耗而对浮游植物生长产生的影响,即减少瓶子效应(bottle effects)的影响[27],因此本研究选择进行为期6 d的营养盐添加实验. 每次采样时使用便携式多参数水质测量仪(YSI 556MPS,美国维塞公司)测定水体温度、pH和溶解氧(DO). 采样当天在实验室完成总氮(TN)、硝态氮(NO3--N)、氨态氮(NH4+-N)、总磷(TP)、磷酸盐(PO43--P)和叶绿素a(Chl a)质量浓度的测定. 水样处理和测定方法按照《水和废水监测分析方法》[28]进行. 此外,本课题组前期研究发现,钾离子(K+)也会影响水华藻种,特别是铜绿微囊藻的生长[29]. 由于目前所涉及到的营养盐添加方案在添加KNO3与K2HPO4的同时,均向实验体系中加入了大量的K+,因此本研究也解析了K+与浮游植物生长的关系. K+质量浓度采用原子吸收分光光度法进行测定[30].
-
浮游植物比生长速率按照指数增长方程进行计算
式中,μ为浮游植物比生长速率,T1为起始时间,T2为结束时间,X1为T1时的Chl a质量浓度,X2为T2时的Chl a质量浓度.
最大比生长速率(μmax)和半饱和常数(Ku)通过Monod方程进行计算[31]
式中,Cs为各组所添加的营养盐质量浓度. 本文使用添加N质量浓度有梯度的处理组(表 1中编号开头为N和PN的处理组)数据拟合得到在底物为NO3--N时浮游植物的Monod方程,使用添加P质量浓度有梯度的处理组(表 1中编号开头为P和NP的处理组)数据拟合得到在底物为PO43--P时浮游植物的Monod方程.
-
使用体系中Chl a质量浓度与K+质量浓度进行非线性回归分析.
-
采用SPSS 25.0进行数据处理和统计分析,Origin 9.0绘制数据图.
1.1. 研究区域概况
1.2. 原位营养盐添加方案
1.3. 样品采集与测定
1.4. 浮游植物比生长速率计算
1.5. 非线性回归分析
1.6. 数据分析
-
实验期间,水体温度变化区间为29.52~31.21℃,pH值变化区间为7.51~8.02,溶解氧(DO)变化区间为13.04~15.26mg/L(表 2),上述指标无明显变化.
-
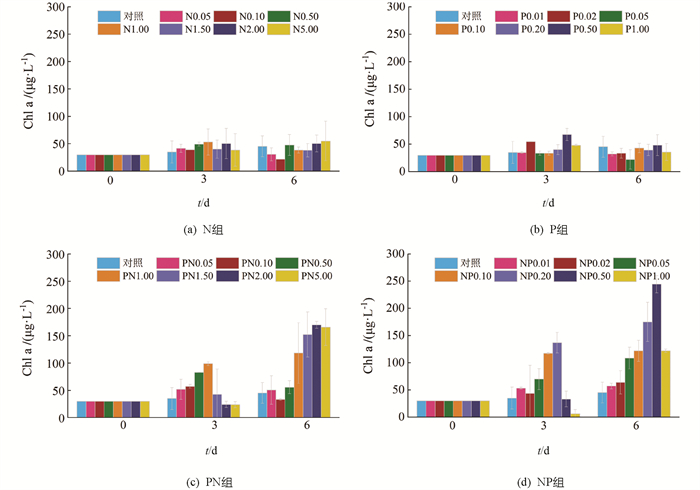
单独添加N的处理组中(以下简称为N组,图 2a),在第3 d时Chl a质量浓度均有不同程度的升高,其中对照组和N5.00组的升高幅度最小,而N1.00组的升高幅度最大,约为初始值的1.8倍(53.3 mg/L);第6 d时,N5.00组的Chl a质量浓度最高(55.0 mg/L),约为初始值的1.8倍,而其余组Chl a质量浓度出现不同程度的降低,这可能与营养盐的缺乏有关. 单独添加P的处理组(以下简称为P组)的Chl a变化趋势与单独添加N组相似(图 1b),其中Chl a升高幅度最大的为P0.50组(67.5 mg/L),约为初始值的2.3倍;在第6 d,除P0.10组外,Chl a质量浓度均有不同程度的降低.
添加不同质量浓度N且同时统一添加1.0 mg/L P的处理组(以下简称为PN组,图 1c)中,第3 d时除PN2.00和PN5.00组Chl a质量浓度有所下降外,其余组均有不同程度的升高,且当N添加质量浓度在0.05~1.00 mg/L范围内,Chl a质量浓度与N质量浓度呈正相关,在N添加质量浓度为1.00 mg/L时Chl a质量浓度达到最高(99.0 mg/L),约为初始值的3.3倍;第6 d时PN1.50,PN2.00和PN5.00组中Chl a质量浓度显著升高,分别达到152.3,169.9和165.8 mg/L,分别为初始值的5.1,5.7和5.6倍.
添加不同质量浓度P且同时统一添加5.0 mg/L N的处理组(以下简称为NP组,图 1d)中,第3 d时P添加质量浓度最高的NP1.00组Chl a质量浓度显著降低,由30 mg/L下降到6.2 mg/L,而其余组Chl a质量浓度均有不同程度的升高;第6 d时所有组Chl a质量浓度均高于第3 d,其中NP0.50和NP1.00组升高幅度最大,分别为初始值的8.2倍(244.4 mg/L)和4.1倍(122.0 mg/L).
-
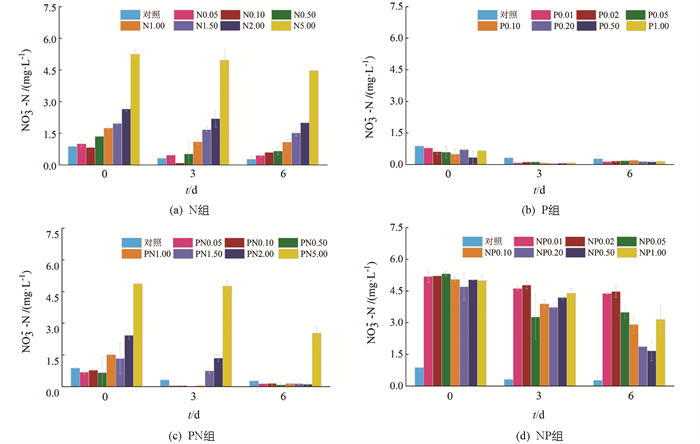
在N组和PN组中,各处理组TN质量浓度均随时间增加而不同程度降低(图 2a,2c),在相同N添加质量浓度(0.05~5.00 mg/L)下,第6 d时PN组最终TN质量浓度为N组的92.65%,67.69%,80.43%,77.62%,80.85%,74.93%和85.32%,即P的添加会加剧TN的消耗. 在P组中(图 2b),各处理组中第6 d的TN质量浓度均低于初始值. 在NP组中(图 2d),各处理组中第6 d的TN质量浓度均低于初始值,其中NP0.05组的TN质量浓度最低,为初始值的62.94%.
-
在N组中(图 3a),NO3--N质量浓度在第3 d均有不同程度降低,而第6 d除N2.00和N5.00组外,其余组NO3--N质量浓度出现小幅升高,这可能与PO43--P缺乏导致的浮游植物逆生长有关,这种现象也出现在了P组(图 3b). 在PN组中(图 3c),NO3--N质量浓度在第3 d均显著下降,其中PN0.50和PN1.00组下降幅度最大,这与两组中Chl a质量浓度大幅度升高相对应. 在NP组中(图 3d),NO3--N质量浓度在第3 d均显著下降,其中外加P质量浓度在0.05~0.20 mg/L时下降幅度较大,而在第6 d,NP0.50组中的NO3--N质量浓度最低,为初始值的33.15%.
-
在N组中(图 4a),NH4+-N质量浓度与N添加量之间没有明显规律,其中N1.50组在第6 d时达到最低值,为初始值的37.83%. 在P组中(图 4b),第3 d P0.10和P0.50组的NH4+-N质量浓度基本保持不变,其余处理组NH4+-N质量浓度均大幅下降. 在PN组中(图 4c),第3 d N添加量较高的PN1.50和PN2.00组的NH4+-N质量浓度出现大幅升高,但在第6 d又大幅降低,基本回到初始水平,其余处理组在第3 d和第6 d基本保持不变. NP组中NH4+-N质量浓度未见明显变化规律(图 4d).
-
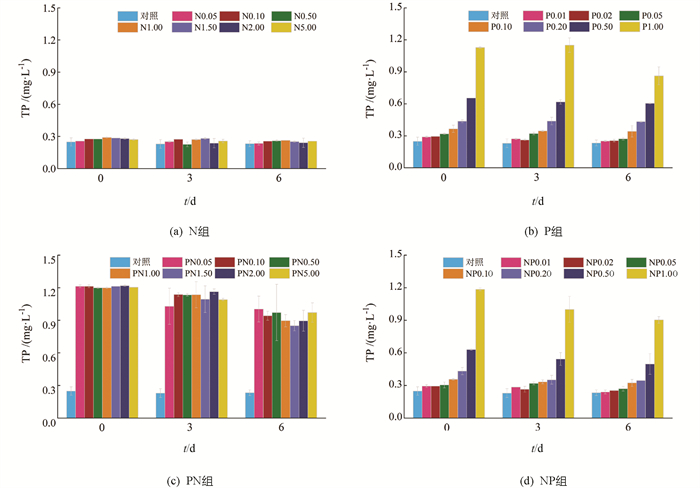
N组中TP质量浓度在实验周期内未发生显著变化(图 5a),而P组内TP质量浓度在1.00 mg/L时降低最为明显,第6 d时体系内TP质量浓度为初始值的76.54%(图 5b). 在PN组中(图 5c),PN1.00,PN1.50和PN2.00组中的TP质量浓度相对降低较多,在第6 d TP质量浓度分别降低为初始值的74.68%,70.03%和73.50%. NP组(图 5d)中NP1.00组的TP质量浓度降低最多,第6 d体系内TP质量浓度为初始值的76.22%.
-
N组中,所有处理组PO43--P质量浓度在第6 d时均降为0,下降幅度达到100.00%(图 6a). P组中,除P1.00组外,其余组中的PO43--P质量浓度持续降低,在第6 d时除P0.50和P1.00组外,其余组PO43--P质量浓度均降低到0(图 6b). PN组中,所有处理组PO43--P质量浓度在第3 d均有大幅降低,在第6 d时,PN0.05,PN0.10和PN0.50处理组的PO43--P质量浓度出现小幅升高,而其余处理组中PO43--P质量浓度持续下降,PN5.00组下降幅度最大,为85.72%(图 6c). NP组中,PO43--P质量浓度在实验周期内持续下降,除P添加量最高的NP1.00组外,其余组的PO43--P质量浓度均在第6 d降为0(图 6d).
-
在N组和P组中,各处理中K+质量浓度在实验周期内未发生显著变化(图 7a,7b). 在PN组(图 7c)中,除PN0.05,PN0.10和PN0.50组外,其余4个较高质量浓度处理组中K+质量浓度在第6 d均显著降低,其中在PN1.00,PN1.50,PN2.00和PN5.00组中,K+质量浓度分别降低至初始值的63.07%,79.12%,92.93%和80.26%. NP组(图 7d)中,K+质量浓度变化趋势与PN组相似,在较高质量浓度的NP0.10,NP0.20,NP0.50和NP1.00组中,第6 d时K+质量浓度分别降低至初始值的87.48%,74.43%,89.65%和88.26%.
-
浮游植物在不同NO3--N和PO43--P质量浓度下的比生长速率见图 8,从非线性拟合生长曲线可以看出,浮游植物呈现出比生长速率随NO3--N或PO43--P质量浓度的增加而增长的趋势.
N组中,当NO3--N质量浓度达到2.0 mg/L时,浮游植物比生长速率不再明显升高,此质量浓度即为浮游植物生长的营养盐上限阈值,最大比生长速率为0.29 d-1,半饱和常数为0.071 mg/L. P组中,当PO43--P质量浓度达到0.50 mg/L时,浮游植物比生长速率基本不再升高,最大比生长速率为0.26 d-1,半饱和常数为0.008 mg/L. PN组中,最大比生长速率为0.90 d-1,是N组的3.10倍,半饱和常数为1.050 mg/L,略高于N组. NP组中,浮游植物最大比生长速率为1.11 d-1,是P组的4.27倍,半饱和常数为0.220 mg/L,趋势与P组基本一致.
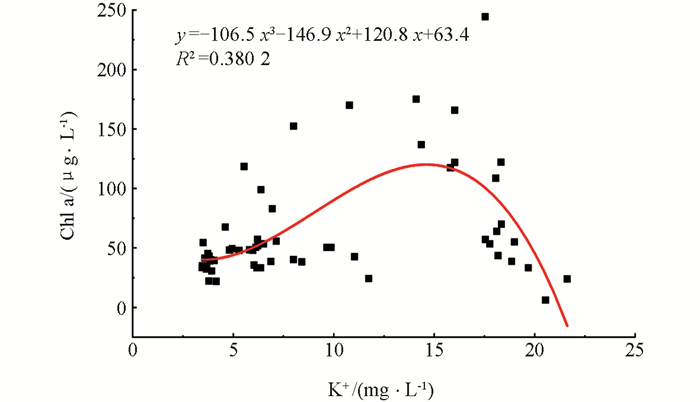
对Chl a和K+质量浓度进行非线性回归分析(图 9),得出K+质量浓度(x)与Chl a质量浓度(y)之间的关系为y=-106.5 x3-146.9 x2+120.8 x+63.4(R2=0.380 2). 在一定K+质量浓度范围(3.45~21.62 mg/L)内,Chl a质量浓度随着K+质量浓度的升高先增后减,拐点时K+质量浓度大约为15 mg/L,可推测K+质量浓度也影响了浮游植物的生长.
2.1. 环境参数变化
2.2. Chl a质量浓度变化
2.3. 氮质量浓度变化
2.3.1. TN质量浓度变化
2.3.2. NO3--N质量浓度变化
2.3.3. NH4+-N质量浓度变化
2.4. 磷质量浓度变化
2.4.1. TP质量浓度变化
2.4.2. PO43--P质量浓度变化
2.5. K+质量浓度变化
2.6. 浮游植物生长响应
-
在共同添加N和P处理组的初始阶段,当一种营养盐保持在较高的添加量时(PN组P添加质量浓度保持为1.00 mg/L,NP组N添加质量浓度保持为5.00 mg/L),随着另一种营养盐添加量的升高,浮游植物生长速率也随之增加(图 8),说明N和P均对浮游植物的生长存在限制作用,但相较于添加有梯度的N组和P组的浮游植物比生长速率增加更明显,因此可以推测御临河泄水期的浮游植物生长由N和P共同限制,且P可能是主要的限制因子.
当营养盐质量浓度达到较高水平,浮游植物生长放缓甚至出现逆生长现象(图 1a,1b),说明可能存在高质量浓度营养盐限制浮游植物生长的现象,一项在太湖的研究也发现过高的N,P质量浓度会抑制水华藻群体的生长[32]. 在实验后期,营养盐添加质量浓度较高组的Chl a质量浓度均大幅升高(图 1),这可能是营养盐的添加导致浮游植物组成结构发生变化,优势种显著增长. 已有研究表明,营养盐添加可以显著改变体系中浮游植物的群落结构,且优势种变化更为明显[33]. 因此,本研究营养盐添加体系中可能发生初期耐高盐浮游植物生长且不耐高盐浮游植物衰亡、后期以耐高盐浮游植物生长为主的演替过程.
单独添加N的处理组(N组)和保证PO43--P维持较高质量浓度而NO3--N有质量浓度梯度的处理组(PN组)达到最大比生长速率时对应的NO3--N质量浓度和半饱和常数均略有差异,且后者的最大比生长速率为前者的3.10倍(图 8),因此选择后者的半饱和常数1.050 mg/L作为控制质量浓度;单独添加P的处理组(P组)和保证NO3--N维持较高质量浓度而PO43--P有质量浓度梯度的处理组(NP组)中浮游植物达到最大比生长速率时对应的PO43--P质量浓度和半饱和常数略有差异,且后者的最大比生长速率为前者的4.27倍(图 8),取后者的半饱和常数作为控制质量浓度,对应的半饱和常数为0.220 mg/L. 因此,NO3--N和PO43--P质量浓度分别在1.050 mg/L和0.220 mg/L以下,才有望控制御临河泄水期浮游植物的生长速率.
-
K+作为生物体中重要的代谢辅助因子,在细胞运输和生物合成方面有着重要的作用[34],同时K+作为淡水中占比最大的4大阳离子之一,其在世界范围内天然水体中均有分布,浓度在0.1~1 000 μmol/L之间[35]. 在水体富营养化研究领域,采用营养盐添加实验进行藻类生理研究时常选择KNO3与K2HPO4作为无机氮源和磷源[20, 36-39],却忽略了该营养盐添加方式带入的大量K+与浮游植物生长之间的关联. 在本研究部分处理组中,我们发现在一定K+质量浓度范围(3.45~21.62 mg/L)内,Chl a质量浓度随着K+质量浓度的升高先增后减,拐点出现在K+质量浓度为15 mg/L左右. 尽管在本研究所构建的体系中,K+质量浓度的存在是因为N,P的添加,即图 9中Chl a与K+的回归关系出现可能是因为K+质量浓度与N和P质量浓度本就存在线性关系. 我们前期的研究结果也发现,在实验室条件下,当培养体系中K+质量浓度为0时,铜绿微囊藻的生长受到显著抑制,且抑制作用随着K+质量浓度升高而降低,铜绿微囊藻生长最适的K+质量浓度为17.99 mg/L,而当K+质量浓度高于17.99 mg/L时,生长抑制作用又开始出现[29]. 因此应针对现有以KNO3与K2HPO4作为外加氮源和磷源的研究,探讨同时加入实验体系的K+是否是被忽略的浮游植物生长限制因子,以及未来营养盐添加时是否可以不选择KNO3以避免K+的影响.
-
三峡库区“蓄清排浊”的运行模式决定了其支流在水动力方面与自然河道存在显著区别[40],在2000年到2015年,多条支流出现了富营养化现象,水华频繁发生,且发生频率从上游向下游地区逐渐增加[41]. 在多样的水动力、温度、营养盐负荷、藻类群体结构组成的影响下,不同支流中限制浮游植物生长方面存在不同的限制因子,尤其是在营养盐限制方面存在差异. 例如香溪河[21]和汝溪河[42]中浮游植物生长的主要限制因子是P,大宁河[20]中的限制因子是N,而本研究发现御临河中浮游植物的生长由N和P共同限制,其中P是主要的限制因子. 造成不同支流浮游植物生长营养盐限制因子不同的原因可能有两种:一是研究方法不同. 本研究采用原位营养盐添加实验,通过监测浮游植物对营养盐添加的响应来识别营养盐限制因子,而其余支流往往根据对支流水质状况与浮游植物生长状况的长期监测,通过数据变化直接进行营养盐限制因子的识别[21, 42],或是通过相关性分析等统计学方法来解析浮游植物生长与不同营养盐因子之间的关系[20];二是三峡库区不同支流本身的浮游植物组成不同,例如香溪河中硅藻、绿藻与蓝藻分别占34.6%,38.5%与10.3%[21],汝溪河中绿藻、硅藻与蓝藻分别占41.88 %,23.93 %与18.80 %[42],而在大宁河[20]和御临河中[43]则以硅藻与绿藻为主. 不同浮游植物在生长、迁移、对营养盐利用方面的差异可能造成不同支流浮游植物限制因子的差异. 因此,应采用相同的研究方法统一对三峡库区不同支流进行营养盐限制因子的识别与比较. 除营养盐限制浮游植物生长外,水体流速是抑制神农溪库湾藻类生长的主要因素[44],水温的升高是澎溪河回水区中蓝藻生长的关键因素[45]. 因此,三峡库区支流的富营养化控制措施应根据不同支流的实际水动力、温度、营养盐等状况,确定浮游植物的生长限制因子,而后制定相应的控制措施.
3.1. P是泄水期御临河浮游植物生长的主要限制因子
3.2. K+是浮游植物生长的潜在限制因子
3.3. 不同三峡库区支流浮游植物生长限制因子的差异性
-
1) 单独添加N或P并不能显著促进浮游植物的生长,浮游植物生物量最高时分别为初始值的1.8倍和2.3倍;N,P共同添加的处理组中浮游植物生长明显,浮游植物生物量最高时分别为初始值的5.7倍和8.2倍,与浮游植物比生长速率的趋势一致. 这说明御临河富营养化由N和P共同限制,且P是主要的限制因子.
2) 当控制NO3--N质量浓度在1.050 mg/L,PO43--P质量浓度0.220 mg/L以下,有望有效控制泄水期御临河中浮游植物的生长速率.
3) 水体中Chl a质量浓度呈现出随着K+质量浓度的升高先增后减的趋势,表明K+可能在浮游植物生长乃至水华过程中有一定影响.











 DownLoad:
DownLoad: