-
开放科学(资源服务)标识码(OSID):

-
山药(Dioscorea opposita Thunb.)是薯蓣科(Dioseoreaceae)薯蓣属(Dioscorea L.) 1年生或多年生的单子叶缠绕蔓性藤本植物[1]。全球已记录的山药约有600种,且广泛分布于亚热带和热带区域,其中中国是山药的起源和驯化中心之一,种质资源极为丰富,共有65种,在许多地区都有种植[2-3]。山药也是全球10大重要的可食用块茎和根茎植物之一,仅次于马铃薯、木薯和甘薯[4]。山药是最具代表性的药食同源性植物,其重要性在《神农本草经》和《本草纲目》中均有记载[5]。山药不仅富含抗性淀粉、蛋白质、氨基酸、可溶性糖等人体所需的营养成分,还含有胆碱、尿囊素、皂甙等药用成分[6]。现代医学对山药多种成分进行药理分析后发现,山药具有抗氧化、延缓衰老、抗肿瘤突变、降血糖血脂、调节免疫力等疗效[7]。
植物的繁殖分为有性繁殖和无性繁殖[8]。有性繁殖主要是以种子或者果实的形式进行种群繁衍和扩张[9],是通过种子作为载体来传递遗传物质,克服了米勒棘齿效应,提供了遗传变异和进化潜能,往往更能适应不同环境[10]。无性繁殖是通过匍匐茎、根状茎等营养器官将母本全部基因传递给后代[11]。与有性繁殖相比,无性繁殖成功率更高、性状更稳定、种群优势更明显,但是存在变异性低、适应性差等缺陷[12-13]。山药一般是采用多种营养器官进行无性繁殖,所以在山药新品种选育过程中存在变异性差、基因池多样性下降、周期太长等问题。
化学诱变剂已被广泛用于诱导动植物的功能性变异,其中EMS是常用的诱变剂之一[14]。EMS能够通过碱基序列中核苷酸碱基对的替换实现点突变,产生错义或无义突变,在植物全基因组中引起随机突变,从而引起一系列的功能变化[15-16]。EMS诱变已经在水稻(Oryza sativa L.)、苦荞(Fagopyrum tataricum)、番茄(Solanum lycopersicum)等植物中构建了突变体库[17-18]。
近年来,山药独特的营养价值和药用价值日渐受到人们的喜爱和重视,进而对山药优良品种的需求也日益增加[19],但山药的育种研究进展缓慢,尤其在优良品种选育、良种繁育以及功能基因挖掘利用等方面基础薄弱[20]。目前,山药主要育种方法有引种、选择育种和诱变育种[21]。为了获得高产优质的山药品种,研究者通过物理(60 Co-γ射线)和化学诱变(EMS)的育种方法获得山药突变体,比如铁棍1号、晋山药1号、苏蓣3号等[22-25]。与传统的系统选育相比,诱变育种突变频率高、范围广、操作简单,克服了山药无法杂交的难题[26-27]。本研究比较不同浓度EMS诱变处理下,对5种山药种质资源零余子致死率的影响,通过回归分析,确定EMS诱变的适宜浓度[28-29],选择最敏感材料进行EMS批量处理,观察并鉴定诱变群体的表型变异,旨在为创造新种质、培育新品种奠定理论基础,同时提供育种的基础材料。
HTML
-
试验材料均来自于山西农业大学经济作物研究所山药种质资源圃(表 1)。
-
0.1 mol/L pH值为7的磷酸缓冲液配置EMS溶液,浓度梯度为0(CK)、0.6%、0.8%、1.0%、1.2%。选取完整的零余子(直径1~2 cm),清洗干净后,蒸馏水浸泡8 h,吸干水分,用湿毛巾将其包裹装入塑料袋,置于人工气候箱中,每2 d喷1次雾状水(以打湿毛巾为准)。零余子表面80%以上呈现白色点状凸起时,转入不同浓度的EMS溶液中,置于25 ℃,150 r/min摇床震荡30 h,用自来水冲洗6 h,每个处理100个零余子,重复3次。
选取半致死剂量最低的材料作为最敏感材料,最佳浓度的EMS处理其零余子3 000粒,收获的子代记为M0。2020和2021年分别调查M1、M2代植株的变异情况。
-
诱变处理后的零余子种植于10 m × 2.4 m的试验田中(山西农业大学经济作物研究所),种植规格:株距20 cm、行距60 cm,按常规方法进行田间种植和管理。
-
式中,R出苗为出苗率;T35为第35 d出苗总数;N供试为供试种子数;R成苗为成苗率;T50为第50 d成活苗总数;R′出苗为相对出苗率;R处理为处理的出苗率;R对照为对照的出苗率;R′成苗为相对成苗率;R′处理为处理的成苗率;R′对照为对照的成苗率;V为变异率;N突变为突变株数;N总为群体株数。
-
2018年,调查5种山药的出苗率和成活率。2020—2021年,调查平遥岳壁山药M1和M2代植株的变异情况。调查内容包括节间长、叶形、叶序、分枝数、主茎形状等(表 2),其中叶形、叶序、主茎形状变异的调查时期为山药茎叶生长期至块茎迅速膨大前期,节间长和分枝数变异的调查时期是在山药进入成熟期,统计每个表型突变个数及变异率。
-
采用SPSS 19.0进行统计分析,Excel 2013进行数据记录整理和作图。
1.1. 试验材料
1.2. 试验方法
1.2.1. EMS诱变剂处理
1.2.2. 诱变后零余子播种方法
1.3. 指标测定
1.4. 突变体表型性状调查
1.5. 数据处理
-
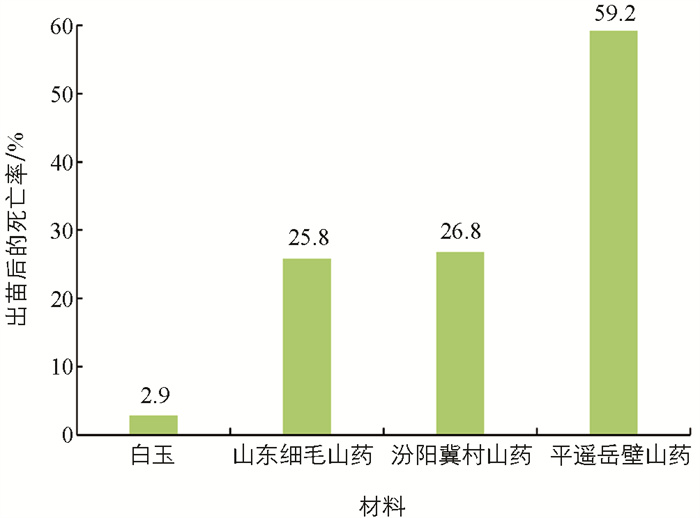
不同浓度的EMS溶液处理同一山药材料的零余子后,各材料的出苗数和成活数均有明显的下降(表 3)。不同材料间对EMS的敏感性存在差异,EMS浓度在0.6%和0.8%时,5种材料的出苗数和成活数保持一致;EMS浓度为1.0%时,2种材料(汾阳冀村山药和平遥岳壁山药)的出苗数和成活数存在较大差异;EMS浓度为1.2%时,只有晋山药1号的出苗数和成活数保持一致,白玉出苗后有2.9%死亡,山东细毛山药出苗后有25.8%死亡,汾阳冀村山药出苗后有26.8%死亡,平遥岳壁山药出苗后有59.2%死亡(图 1)。
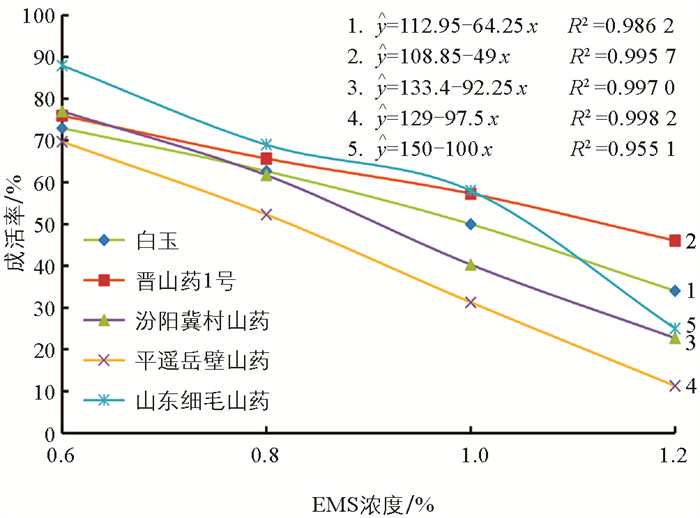
EMS不同浓度处理后对不同品种山药零余子的成活率进行回归趋势分析,结果显示5个不同山药品种零余子EMS诱变的半致死剂量分别为:白玉0.98%、晋山药1号1.20%、汾阳冀村山药0.90%、平遥岳壁山药0.81%、山东细毛山药1.00%(图 2)。不同来源种质的山药零余子对EMS的敏感性不同,半致死剂量存在差异性,为0.81%~1.20%,敏感程度由高到低依次为:平遥岳壁山药、汾阳冀村山药、白玉、山东细毛山药、晋山药1号。
-
选择敏感程度最高的平遥岳壁山药构建突变体库,选用浓度0.8%的EMS处理3 000粒零余子,成活1 453株。2020和2021年分别调查M1、M2代植株的变异情况,M1到M2代的变异株由376株变为301株,变异率由25.88% 变为20.72%,其中能稳定遗传的有136株(表 4)。
平遥岳壁山药总变异率为9.36%,代表型变异以主茎变异率最高,为3.86%,占总变异率的41.24%;以叶形变异最为丰富,有12个变异类型,变异率为3.46%,占总变异率的36.97%,其中50株是由M1代遗传的;叶尖变异次之,变异率为1.25%,占总变异率的13.35%,其中18株是由M1代遗传的;叶基和叶色变异居第3位,变异率为0.41%,占总变异率的4.38%,其中6株是由M1代遗传的(表 4)。
-
平遥岳壁山药叶形为戟形,叶尖细长、渐尖,中下部具2个较深叶裂,叶面平展,叶色和叶缘色均为绿色(图 3-CK)。诱变处理后,叶形变异包括三角形(图 3-1)、圆心形有叶裂(图 3-2)、圆心形无叶裂(图 3-3)、长心形(图 3-4)、机翼形(图 3-5~6)、圆卵形(图 3-7)、蝴蝶形(图 3-8)、复叶(图 3-9)、非对称叶左右叶耳大小不等(图 3-10~11)、非对称叶叶片一部分缺失(图 3-12~13)、内卷(图 3-14~15)、叶片皱缩(图 3-16~17)、叶面中心凸起(图 3-18)、原叶裂一侧下方出现新叶裂(图 3-19~20);叶尖变异类型有短尖(图 3-21)、弯曲向一侧(图 3-22)、圆盾(图 3-23)、二裂(图 3-24)、平截(图 3-25)、弯月(图 3-26);叶基变异类型有直线形(图 3-27)、抱茎(图 3-28~29);叶色变异叶缘为深紫色(图 3-30)、全叶颜色浅绿色(图 3-31)。
-
平遥岳壁山药主茎为圆柱形,茎上叶序为对生;突变体植株主茎变为偏平状,叶序混乱,且叶稍也较粗,叶序呈3叶互生、4叶轮生等不规则、无规律排列(图 4,图 5),该类型变异率为0.28%,占总变异率的2.99%,其中4株是由M1代遗传的(表 4)。
-
平遥岳壁山药正常植株主茎分枝数5~7条,节间平均长度为5 cm,诱变群体出现无分枝植株(图 6a),或主茎分枝数变多,为15~17条(图 6b)和主茎节间变长,为10~13 cm(图 6c)。主茎分枝数变多类型变异率最高,为1.45%,占总变异率的15.49%,21株是由M1代遗传的;主茎节间变长类型变异率次之,为1.24%,占总变异率的13.25%,18株是由M1代遗传的;无分枝类型变异率最低,为0.89%,占总变异率的9.51%,13株是由M1代遗传的(表 4)。
2.1. 不同EMS浓度处理山药零余子
2.2. 平遥岳壁山药突变体库的构建
2.2.1. 田间表型调查情况
2.2.2. 叶片形态变异情况描述
2.2.3. 主茎形状、叶序变异
2.2.4. 分枝数和节间变异
-
自然或人工产生的突变体被认为是在确定的种质基因池中开发具有新期望性状非常有用的方法[26-27]。山药的开花习性和繁殖方式较为特殊,传统杂交方法难以产生遗传重组和变异。甲基磺酸乙酯(EMS)是一种烷基化化学诱变剂,其处理已经成功帮助种子和营养繁殖植物中新品种的开发[28]。这种诱变剂很容易使用,没有技术壁垒和高精设备的要求,可以提供一个非常高的随机点突变频率[29]。化学诱变产生的突变体是分子育种中基因挖掘和新品种繁殖不可或缺的一部分[30-31]。通过EMS诱变培育新品种的案例已有许多报道,比如耐旱马铃薯植株的选育、甘薯耐盐品种的选育和甘薯贮藏根储存含量的选育等[32-34],但山药在这方面的报道较少。
EMS的浓度、处理时间和方法、营养器官的选择等都是影响EMS化学诱变效果的因素[35]。通常以诱变处理后植株成活率在1/2时(半致死剂量)来确定EMS的浓度和处理时间[36]。本研究利用不同浓度梯度的EMS(0、0.6%、0.8%、1.0%、1.2%)诱变处理5个不同山药材料的零余子(白玉、晋山药1号、汾阳冀村山药、平遥岳壁山药、山东细毛山药),通过对其成活率进行回归趋势分析得出:5种山药材料的EMS适宜浓度为0.98%、1.20%、0.90%、0.81%、1.00%;3份来源于山西的山药适宜浓度区别较大,相差0.33%;2份来源于山东的山药适宜浓度区别较小,相差0.02%;对EMS的诱变敏感程度顺序由高到低依次为平遥岳壁山药、汾阳冀村山药、白玉、山东细毛山药、晋山药1号。这一现象可能是由于其材料内部全基因组序列的差异所导致,需要进行后期研究加以论证。
本研究选用敏感性强的平遥岳壁山药来构建突变体库,并产生了丰富的突变类型。突变体有表现出前期生长缓慢、长势弱、后期与野生型生长一致的现象;叶形有戟形变为圆心形,或形成复叶、非对称叶等类型;主茎宽而扁平,叶序混乱,这一现象在拟南芥中有过报道[37]。我们计划在DNA水平上解析突变体的变异机理,以了解这些变化表型内部的分子机制。利用该突变体库,对山药叶形的变异、主茎形状和叶片颜色等突变性状进行基因挖掘和克隆。
突变体库是研究功能基因组学的重要工具,可以在许多植物物种中进行构建[38-40]。由于并非所有EMS突变都表现出视觉变化,因此仍然需要对这些突变体进行额外的筛选,例如靶向诱导的基因组局部病变(TILING)等[41-42]。除了田间性状调查,在未来的测试中,还有必要结合山药的抗病性和品质等其他性状进行筛选。
-
用EMS诱变零余子对山药进行种质创新和新品种培育,选择适宜的诱变浓度和敏感材料最为关键。本研究通过对5个不同山药品种零余子进行不同EMS浓度的处理,筛选出了5个品种的EMS适宜浓度,为0.81%~1.20%,对EMS的诱变敏感程度顺序由高到低依次为平遥岳壁山药、汾阳冀村山药、白玉、山东细毛山药、晋山药1号。对最敏感材料采用最适浓度进行批量处理后,总变异率为9.36%。代表型变异以主茎变异率最高,为3.86%,占总变异率的41.24%;以叶形变异最为丰富,有12个变异类型,变异率为3.46%,占总变异率的36.97%。










 DownLoad:
DownLoad: