-
青脆李(Prunus americana)属双子叶植物纲蔷薇目蔷薇科(Rosaceae),核果类果树. 目前,李的商业品种主要分为中国李(P.salicina Lind L.)和欧洲李(P.do mestica L.)[1]. 据世界粮农组织(World Food and Agriculture Organization)统计,2017年我国李产量680.4万t,占全世界总产量的57.8%,位列世界第一. 青脆李种植地主要分布在我国南方地区,云、贵、川地区居多. 在重庆,青脆李不仅是高寒山区农民增收致富的主导品种,也是乡村休闲体验游的重要载体[2]. 青脆李是呼吸跃变型果实,具有养阴生津、润肠通便、补中益气等药用价值,还富含糖、多种氨基酸、维生素和矿物质[3-4],食用价值高,又由于其甜脆爽口的独特风味而深受消费者喜爱. 目前,随着人民生活水平的不断提升和对外销售的优势不断增强,优质李果需求越来越旺盛,青脆李的价格也在不断攀升,因此,青脆李果实的发育特性和采后果实的生理代谢及贮藏特性也逐步受到更多的关注.
果实的糖分种类、质量分数及其构成比例和形成动态是果实风味形成的重要基础之一,是决定果实品质和商品价值的主要因素[5]. 蔗糖代谢、山梨醇代谢、己糖代谢和淀粉代谢途径是目前公认的4大糖代谢途径,这几种途径均由不同类型的代谢酶参与. 不同物种间糖积累机制存在较大差异[6],代谢酶的调控作用也存在较大的差别. 目前关于蔗糖代谢的主要代谢酶有酸性转化酶(AI)、中性/碱性转化酶(NI)、蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)等[7];淀粉代谢酶主要包括尿苷二磷酸葡萄糖焦磷酸化酶(UGPase,UTP-glucose-1-phosphate uridylyltransferase)、腺苷二磷酸葡萄糖焦磷酸化酶(AGPase,ADP-glucose pyrophosphory)、α- 淀粉酶(α-AL,l,4-α-D-glucan glucanohydrolase)、β-淀粉酶(β-AL,l,4-α-D-glucan maltohydrolase)[8]. UGPase与糖原合成、半乳糖利用、糖蛋白合成有关,在碳水化合物代谢中起核心作用. UGPase通过提供UDP-葡萄糖,再由蔗糖代谢的SPS形成蔗糖[9-11]. AGPase主要是催化淀粉合成前体ADP-葡萄糖,调控淀粉和蔗糖代谢、氨基糖与核糖代谢. α-AL为内切酶,通过切割淀粉中的1,4-糖苷键,将直链淀粉水解成麦芽糖和麦芽三糖,再将麦芽三糖水解成葡萄糖和麦芽糖,从而调控淀粉和蔗糖代谢. β-AL为外切酶,只能切割1,4-糖苷键,然后产生麦芽糖和限制性糊精,主要负责调控淀粉和蔗糖代谢. 果胶酶(Pectinase)是一种分解果胶的功能酶,其质量分数和活性会影响到细胞壁的稳定性,不仅影响裂果的产生,对果实软化也有直接作用[12-13]. 多聚半乳糖醛酸酶(PG)和果胶酯酶(PE)主要是分解细胞壁中的果胶,破坏或降低细胞壁的延展性. 果胶裂解酶(PL)能够水解果胶产生水溶性果胶,切断聚甲氧基半乳糖醛酸和阿拉伯糖之间的化学键,从而降解果胶[14]. 山梨醇是梨属等蔷薇科木本果树最主要的光合作用产物[15-16],山梨醇作为连接着“源”端碳物质积累和“库”端各种糖组分之间的相互转化的物质,影响着各“库”器官的生理变化,对“库”器官的功能和作用机制至关重要. 山梨醇可以通过NAD+型山梨醇脱氢酶(sorbitoldehydrogenase,NAD+-SDH)转化成果糖,然后果糖进一步转化成蔗糖或淀粉等其他糖类物质,而且NAD+-SDH也可催化山梨醇和葡萄糖之间的相互转化.
目前,国内外对糖代谢的研究主要集中在苹果[17]、猕猴桃[18]、梨[19]、草莓[20]等水果,关于青脆李糖代谢的研究较少. 为此,我们研究了青脆李采后果实低温贮藏下果肉的糖代谢特性,特别是果实蔗糖代谢的特性及变化规律,通过测定和研究果胶、淀粉、蔗糖、果糖、葡萄糖、山梨醇等6种糖组分及相关酶活性的消长变化,明确青脆李采后组分的量变关系,确定青脆李采后的主要糖代谢路径,为今后调控青脆李采后果实风味及品质提供理论依据.
HTML
-
青脆李采自重庆市綦江区通惠水果人农场.
EX324ZH电子分析天平,上海上天精密仪器有限公司;GL-12A高速冷冻离心机,上海菲恰尔分析仪器有限公司;UV-6000PC紫外可见分光光度计,上海元析仪器有限公司;HH-4电子恒温水浴锅,常州国华电器有限公司;DHG-9053J恒温鼓风干燥箱,上海三发科学仪器有限公司;HR2104匀浆机,飞利浦公司;全波长酶标仪,美国基因公司SYNERGYH1MG.
-
挑选果型端正、大小均匀、无病虫斑和机械损伤的果实,每个果实均套上6 cm×5 cm PE泡沫网套,采收当天处理. 按每筐100个左右装入已消过毒的塑料筐中,筐外套0.05 mm厚度聚乙烯薄膜袋,袋自然合拢,不扎口. 置于5 ℃,相对湿度为95.0%左右的冷库中贮藏. 平均分成6组,每组2份,每份为1 kg左右,大约30颗,预冷后为第一次取样,然后每7 d同一时段取样1次. 取样时,将青脆李去核低温榨汁后分3组贮藏于-80 ℃超低温冰箱中,用于糖组分和酶活性测试. 总共取样6次,每次重复测3组,实验周期为35 d. 在贮藏过程中,总共测定6种糖类,包括果胶、淀粉、葡萄糖、果糖、蔗糖、山梨醇. 酶活性的测定包括果胶代谢:果胶酯酶(PE)、果胶裂解酶(PL)、多聚半乳糖醛酸酶(PG),糖代谢:蔗糖磷酸合成酶(SPS)、蔗糖合成酶分解方向(SS-Ⅰ)、蔗糖合成酶合成方向(SS-Ⅱ)、中性/碱性转化酶(NI)、可溶性酸性转化酶(S-AI)、细胞壁不溶性酸性转化酶(B-AI),山梨醇代谢:山梨醇脱氢酶(NAD+-SDH),共10种代谢酶. 6种糖类和10种酶活性的检测均采用苏州格锐思生物科技有限公司的试剂盒进行检测.
-
实验3次重复,酶活性单位为μmol/(h·g). 用SPSS 20.0软件进行数据统计分析,采用origin 2018作图. p<0.05,p<0.01为差异有统计学意义.
1.1. 材料与仪器
1.2. 实验方法
1.3. 数据处理
-
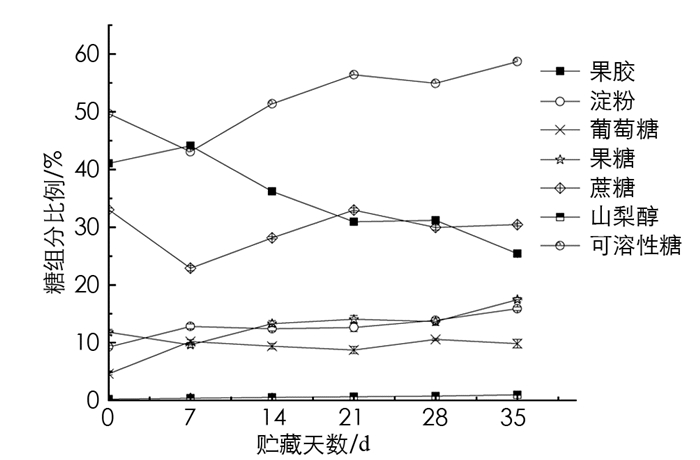
从其构成来看,果胶和蔗糖是青脆李果实的主要糖组分,分别占6种糖组分的34.83%和29.58%;果糖、淀粉、葡萄糖、山梨醇质量分数占总糖质量分数分别为13.31%,12.81%,8.89%,0.58%.蔗糖在贮藏过程中呈波动下降趋势,淀粉占比高于葡萄糖,但与葡萄糖质量分数变化趋势相近,都呈现先增加后减少的趋势. 果胶质量分数呈现先上升后下降的趋势. 果糖质量分数在7~14 d内不断增加,而7~14 d内葡萄糖质量分数逐渐下降,其后维持在相对稳定的水平. 山梨醇的质量分数呈线性增长趋势,占比从0.24%增加至0.86%(图 1).
-
对青脆李果实与糖质量分数间进行相关性分析,结果表明,蔗糖是青脆李果实中重要的可溶性糖. 青脆李贮藏过程中,果实中蔗糖质量分数与淀粉、葡萄糖质量分数呈极显著负相关,相关系数分别为-0.710和-0.913;与果糖质量分数呈显著正相关,相关系数为0.478;与可溶性糖质量分数呈极显著正相关,相关系数为0.961. 说明果实发育过程中,总糖质量分数的增加,主要贡献是因为蔗糖质量分数的增加. 果胶质量分数与山梨醇质量分数呈显著正相关,相关系数为0.564(表 1).
-
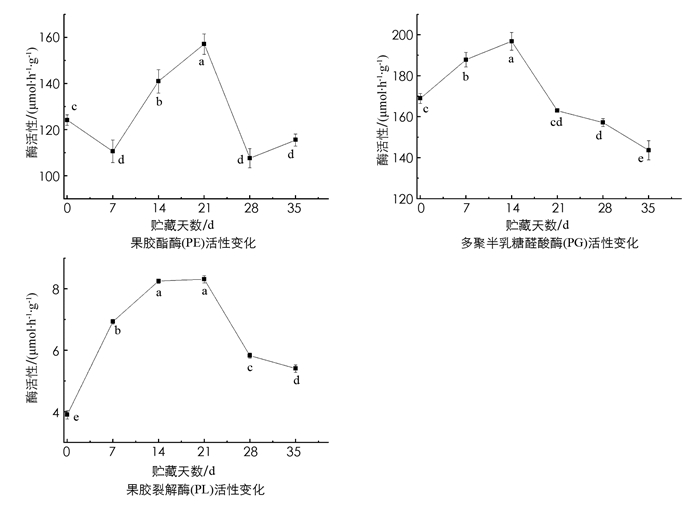
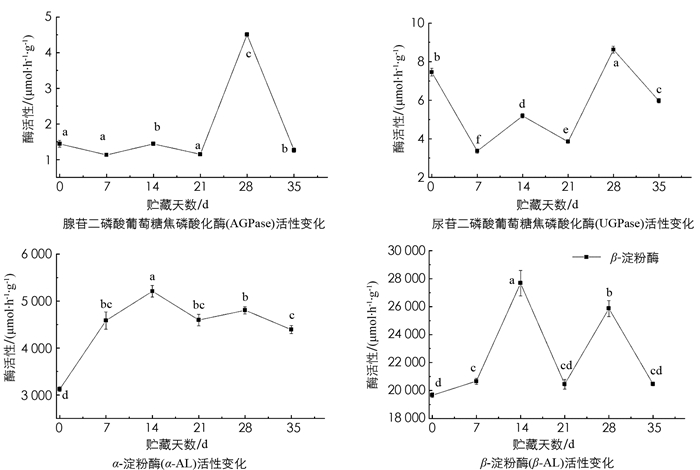
研究表明,采后青脆李果实中果胶酯酶(PE)活性变化趋势为先下降后上升然后再下降,在采后第21 d达到峰值,为152.40 μmol/(h·g). 在第21~28 d PE活性迅速下降,其变化趋势与果胶裂解酶(PL)的变化趋势接近. PL酶活性约为PE酶活性峰值的1/19. 多聚半乳糖醛酸酶(PG)酶活性在1~14 d内持续上升,14 d时达到峰值,为196.83 μmol/(h·g),随后持续下降. 通过对果胶的相关性研究结果可知,果胶的质量分数与PL和PE的酶活性呈负相关,而与PG的酶活性呈显著正相关,相关系数为0.358. PE和PL的相关性有统计学意义,相关系数为0.613. 由此可知,青脆李采后贮藏过程中,原果胶质量分数的降低主要受PG酶活性变化的控制(图 2,表 2).
-
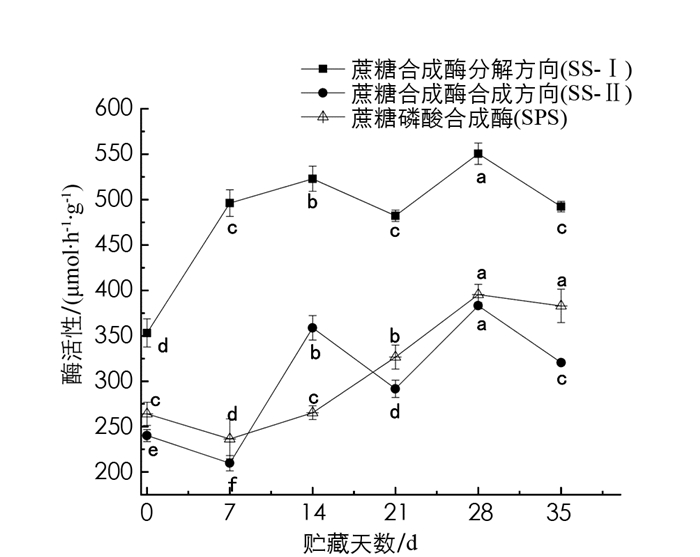
5 ℃下,果肉的蔗糖合成酶分解方向(SS-Ⅰ)活性在贮藏前期(0~14 d)呈上升趋势,而后保持相对稳定;蔗糖合成酶合成方向(SS-Ⅱ)活性在0~7 d呈下降趋势,7~14 d活性迅速增加,随后其活性保持在290.60~383.10 μmol/(h·g)之间. 在第14~35 d内,SS-Ⅰ和SS-Ⅱ活性变化趋势相似,均在第28 d达到峰值,分别为550.52 μmol/(h·g)和383.15 μmol/(h·g). 蔗糖磷酸合成酶(SPS)活性在0~7 d呈先减小、7~28 d呈逐渐升高的趋势,在第28 d达到活性峰值395.439 μmol/(h·g). 相关性分析可知,SS-Ⅰ和SS-Ⅱ呈极显著正相关,相关系数为0.638. SS-Ⅰ活性与葡萄糖质量分数呈极显著正相关,相关系数为0.845;与蔗糖呈极显著负相关,相关系数为-0.847. SPS的酶活性与果糖质量分数、SS-Ⅱ的酶活性呈显著正相关,相关系数分别为0.534,0.662(图 3,表 3).
-
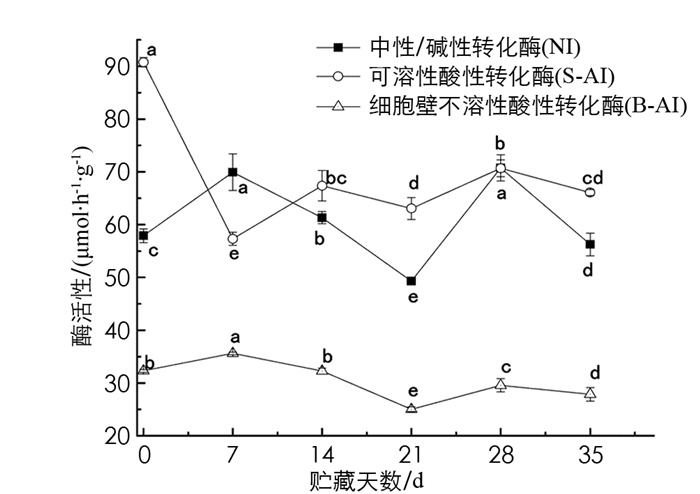
在青脆李果实中,中性/碱性转化酶(NI)活性的波动较大,活性在0~7 d上升,随后14 d迅速下降,在21~28 d又迅速回升,随即又下降到刚采摘时的活性. NI活性与细胞壁不溶性酸性转化酶(B-AI)活性的变化趋势相近,均是在第7 d和第21 d达到最高值和最低值. 不同的是,B-AI活性明显小于NI活性,约占NI活性的1/2.可溶性酸性转化酶(S-AI)活性在0~7 d急速下降,在第7 d达到最低值57.30 μmol/(h·g),随后上升保持在相对稳定的水平. 相关性分析表明,青脆李果实NI活性与葡萄糖呈显著正相关,相关系数为0.586;与果糖呈极显著负相关,相关系数为-0.634. S-AI与葡萄糖质量分数和SS-Ⅰ活性呈极显著负相关(p<0.01),而与蔗糖和果糖质量分数呈显著正相关. B-AI活性与果糖质量分数和SPS活性均呈极显著负相关,相关系数为-0.601和-0.691,而与NI活性呈极显著正相关,相关系数为0.692(图 4,表 3).
-
腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)在前期和中期变化不明显,且酶活性很低;在第21 d酶活性急速上升,28 d时达到峰值,后7 d又急速下降,其变化情况与尿苷二磷酸葡萄糖焦磷酸化酶(UGPase)活性的变化情况相似. UGPase酶活性大约是AGPase酶活性的两倍,但AGPase和UGPase相比其他淀粉酶,其酶活性极低,由此可以推测AGPase和UGPase可能对青脆李中淀粉代谢的影响较小. α-淀粉酶(α-AL)的活性较高,在4 500 μmol/(h·g)左右波动;β-AL的活性也较高,在25 000 μmoL/(h·g)左右波动,其活性几乎是α-AL的5.5倍. α-AL在前期(0~7 d)酶活性持续上升,与淀粉质量分数的变化趋势相近,可能是由于α-AL为内切酶,此时通过切割淀粉中的糖苷键将直链淀粉通过多步水解成葡萄糖和麦芽糖,故α-AL的变化较大且活性较高;β-AL的活性在中后期(21~35 d)的波动较α-AL剧烈,故此时淀粉的水解转化可能是β-AL外切酶在起关键作用(图 5).
-
根据相关性分析可得,AGPase和UGPase酶与5种糖的相关性均较低. 而α-AL活性与蔗糖质量分数和可溶性糖质量分数均呈极显著负相关,相关系数为-0.820和-0.767;与葡萄糖呈极显著正相关,相关系数为0.768. 由此证明淀粉主要转化成了葡萄糖,同时也证明α-AL对可溶性糖的积累具有重要作用. AGPase与UGPase酶活性的相关性极强,相关系数为0.746;α-AL与β-AL的相关性也极强,相关系数为0.699,证明两者之间存在相互协同的作用(表 4).
-
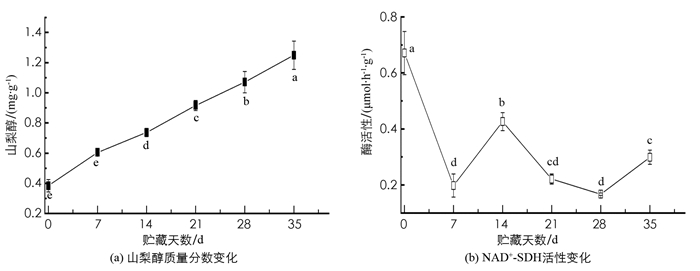
山梨醇质量分数在0~35 d呈现稳定增长状态,而NAD+-SDH呈波动下降趋势,在0~7 d内酶活性迅速下降,7~14 d内酶活上升,14~28 d又继续缓慢下降,最后稍微回升,但仍然低于刚采摘时的活性. 从相关性分析得出,山梨醇与NAD+-SDH呈极显著负相关,相关系数为-0.626(图 6,表 3).
-
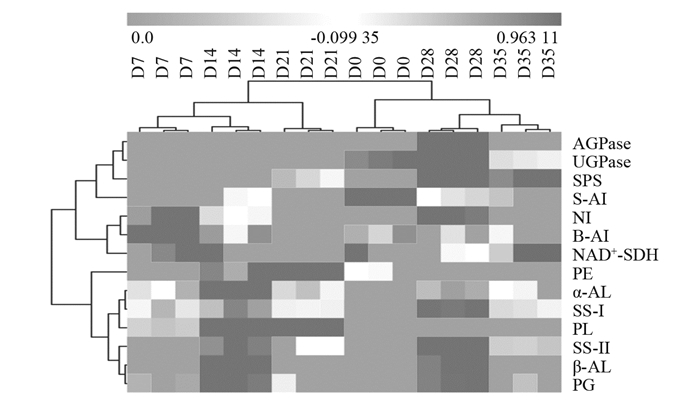
从图 7的分阶聚类热图可以看出,青脆李后熟过程主要在2个阶段:
第一个阶段为采摘后的第7~21 d,在这个时间段,青脆李的糖组分主要以蔗糖、淀粉和山梨醇质量分数的增强与响应为主. 山梨醇代谢NAD+-SDH,蔗糖代谢S-AI,B-AI,NI,SPS和淀粉代谢AGPase和UGPase共7种活性较强的糖代谢酶聚为一组. 在该阶段(7~21 d)青脆李糖的代谢特点:催化蔗糖和山梨醇两种运转糖转化为单糖的反应较为活跃,淀粉降解的代谢强度较高.
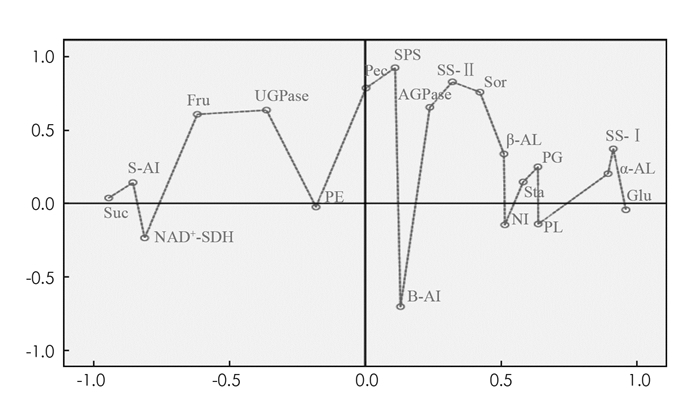
第二个阶段为采后冷藏第28~35 d. 此时以蔗糖代谢、淀粉代谢和果胶代谢为主. 此阶段主要是调控3种果胶酶将原果胶转化成可溶性果胶,从而导致青脆李软化;平衡蔗糖和单糖之间动态消长的SS-Ⅰ与SS-Ⅱ可促进淀粉水解生成还原糖,和α-AL与β-AL的活性同步增强. 图 8显示,贮藏期青脆李果实的糖组分和糖代谢在作为分析变量和补充变量时被分成2个维度,其方差解释为63.65%. 青脆李采后贮藏过程中糖分的主成分依次按照葡萄糖、淀粉→蔗糖、果糖→果胶的顺序转化,主要以蔗糖转化为主. 淀粉水解酶和蔗糖向葡萄糖和果糖转化酶的离散相关性较高,与分阶聚类结果一致. 根据冷藏期间的糖组分和糖代谢酶的主成分分析结果可知,SS-Ⅰ,α-AL和S-AI主成分载荷系数最高.
2.1. 青脆李贮藏过程中不同糖组分所占比例变化
2.2. 青脆李果实贮藏期糖组分之间的相关性分析
2.3. 采后果实果胶质量分数和果胶代谢酶活性的变化
2.4. 采后果实可溶性糖相关酶活性的变化
2.4.1. 采后青脆李贮藏过程中蔗糖合成酶和蔗糖磷酸合成酶活性的变化
2.4.2. 采后青脆李贮藏过程中中性/碱性转化酶和酸性转化酶活性的变化
2.4.3. 采后果实淀粉质量分数和淀粉类酶活性的变化及其相关性分析
2.4.3.1. 采后果实淀粉质量分数和淀粉类酶活性的变化
2.4.3.2. 青脆李果实中糖组分与淀粉相关酶活性的相关性
2.4.3.3. 采后青脆李贮藏过程中山梨醇和山梨醇脱氢酶(NAD+-SDH)活性的变化
2.5. 青脆李采后贮藏过程中糖代谢相关酶之间的响应关系
-
果实采后糖分和酶活性变化虽然不如生长发育期时活跃,但依然是生理活动重要的物质基础和风味品质变化的重要依据. 本实验的结果表明:青脆李果实发育过程中以积累果胶和蔗糖为主,淀粉、葡萄糖和果糖的质量分数约占蔗糖的一半,且3种糖组分质量分数较接近,山梨醇质量分数极少. 果胶质量分数呈现先上升后下降的趋势,表明果胶的代谢涉及多种酶类,其降解是由多种酶共同作用的结果. PG活性在草莓、苹果、香蕉等水果成熟过程中与可溶性果胶呈正相关,PG与溶质型桃果实的软化高度相关,内多糖半乳糖醛酸酶(Endo-PG) 在溶质型桃中的表达量会随着软化进程的推进而显著升高[21-23]. 从青脆李采后果胶酶代谢的情况来看,果胶的代谢主要受PG的调控.
糖卸载到果实中在很大程度上取决于果实本身的“库”强大小,而其重要的生化标志就是关于糖代谢相关酶的活性. 蔗糖转化酶可以在韧皮部卸载位点和库组织细胞之间创造蔗糖梯度,促进蔗糖的转运. 本实验的结果表明:青脆李果实在贮藏过程中蔗糖呈波动下降趋势,葡萄糖质量分数先上升后波动下降,果糖还原糖总体和山梨醇质量分数呈逐渐上升的趋势. 总体来看,可溶性糖质量分数还是呈逐渐递增的趋势,且青脆李果实在低温贮藏期间蔗糖质量分数的降低与葡萄糖质量分数的增加有明显的相关性,这与牛芳英等[24]在研究马铃薯贮藏时糖代谢的实验结果相似. 究其原因可能是刚采摘下来时,果实中S-AI和NI的活性较高,催化蔗糖或者淀粉转化为葡萄糖,导致葡萄糖质量分数上升;而后在果实自身呼吸作用以及蔗糖代谢相关酶活性的作用下,果实中葡萄糖和蔗糖的质量分数均逐渐下降. 其次,蔗糖质量分数与SS-Ⅰ呈极显著负相关,且SS-Ⅰ的酶活性明显高于SS-Ⅱ和SPS,可溶性糖质量分数也与SS-Ⅰ呈极显著负相关,葡萄糖质量分数与SS-Ⅰ呈极显著正相关,证明SS-Ⅰ是影响蔗糖合成的关键酶.
从相关性和酶活性来看,青脆李的可溶性糖代谢积累主要受SS-Ⅰ,S-AI和α-AL等酶的相互调节作用,这与苏艳等[20]在草莓果实的发育过程中的研究结果一致;在杨祎等[25]对草石蚕块茎的研究中同样如此,实验证明SPS,SS和AI是草石蚕块茎中糖积累的重要因子;但与常尚连等[26]在西瓜中的研究结果恰好相反,西瓜果实中的SPS活性在蔗糖代谢中起关键作用,而蔗糖合成酶(SS)活性对蔗糖的积累作用较小. 虽然NAD+-SDH活性较小,但是与可溶性糖的质量分数呈极显著正相关,这是由于NAD+-SDH能够催化山梨醇与果糖及葡萄糖之间的相互转化. 该酶被认为在调控“库”强过程中起到了关键作用[27],山梨醇转运蛋白有可能会受到葡萄糖和果糖的竞争性抑制. NAD+-SDH催化山梨醇生成果糖的能力较强,对果糖积累的贡献相对更高,这可能是青脆李贮藏后期果实中果糖质量分数显著高于葡萄糖质量分数的原因之一[28-29].
诸多研究证明,果实发育中的各种糖类的积累并不是单一种类酶在起作用,而是受各种相关酶的共同调控. 本研究对青脆李采后贮藏过程中果胶和可溶性糖的积累和积累过程中有关酶活性动态变化及主要调控酶进行了研究,但在分子水平上,对其糖代谢及其相关酶的研究尚不清楚. 今后,应当就有关青脆李糖代谢关键酶基因的调控以及糖信号对青脆李果实糖代谢的调控机制进行研究.






 DownLoad:
DownLoad: