-
草地贪夜蛾(Spodoptera frugiperda)又称秋黏虫(Fall armyworm,FAW),起源于美洲热带和亚热带地区[1],具有迁飞能力强、生活周期短和寄主范围广等特点,2017年被国际农业及生物科学中心(CABI)评为世界十大植物害虫之一[2].该虫于2019年1月开始入侵我国云南省,并迅速向北迁飞,对我国的主要农作物造成了极大的威胁[2-5].
昆虫肠道为微生物的定植提供了独特的环境,而肠道菌群也在与宿主的长期协同进化过程中形成了稳定的相互作用关系,对宿主的营养、发育、生殖以及行为产生了重要的影响[6-9]. Wu等人[10]研究发现草翅叶蝉(Homalodisca coagulata)中有两种专性共生菌Baumannia cicadellinicola和Sulcia muelleri,前者可以合成维生素和辅酶因子,后者可以合成大部分宿主所必需的氨基酸,以满足宿主生长发育的需要. Shen等人[11]发现烟草甲(Lasioderma serricorne)体内的酵母类共生体(Symbiotaphrina kochii)能够利用植物化感物质和真菌毒素等作为碳源,从而起到解毒的作用,例如,该类微生物能够水解有机磷杀虫剂对硫磷.目前已有大量研究证实昆虫的肠道菌群有助于昆虫的营养代谢、生长发育和环境适应,参与昆虫的免疫防御系统,抵御寄生虫、病原体的入侵,影响昆虫的寿命,甚至介导种内和种间的通讯[6-9, 12-13].因此,开展昆虫肠道菌群在信息素生成、农药降解和抵抗微生物入侵等方面的作用研究,对害虫生物防治以及新农药的开发上具有重大的意义[14-15].
本课题组在前期实验中分离鉴定了重庆地区采食玉米和高粱的草地贪夜蛾肠道微生物[16-19],从采食玉米的幼虫肠道共分离出8个属的细菌,在采食高粱的草地贪夜蛾肠道中仅分离到了5个属的细菌,可能与首次采集的害虫样本数量较少有关.因此,为进一步比较分析采食不同食物的草地贪夜蛾之间的肠道细菌,课题组再次采集了重庆江津地区高粱地的草地贪夜蛾幼虫50余头,通过传统培养方法分离其肠道细菌,并通过16S rDNA测序对分离株进行鉴定,新分离得到6个属的细菌,并对重庆地区采食高粱叶和玉米叶的草地贪夜蛾以及玉米黏虫肠道优势细菌进行了比较分析.
全文HTML
-
草地贪夜蛾幼虫采自于重庆江津地区高粱地和巫山地区玉米地.
-
改良LB培养基(LBG):胰蛋白胨10.0 g,酵母提取物5.0 g,NaCl 10.0 g,葡萄糖5.0 g,琼脂15.0 g,加蒸馏水至1 000 mL.
-
TE25S溶液:25 mmol/L Tris-HCl,25 mmol/L EDTA,0.3 mol/L蔗糖;DNA提取液:Tris饱和酚/氯仿/异戊醇混合液(各组分体积比为25:24:1, pH>7.8);微生物裂解直接PCR试剂盒,Takara;PCR扩增引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′,由生工生物工程(上海)股份有限公司合成;1×Taq MasterMix(purple),北京博迈德基因技术有限公司.
-
采样自江津地区的草地贪夜蛾幼虫喂食高粱叶饲养,采样自巫山地区的草地贪夜蛾幼虫喂食玉米叶饲养,收集新鲜粪便加入1 mL灭菌的磷酸缓冲液(PBS),震荡制成粪便原液;于超净工作台中,用75%乙醇对幼虫进行表面消毒后,解剖取其中肠置于装有1 mL灭菌的磷酸缓冲液(PBS)的1.5 mL离心管中,震荡混合制成肠道内容物悬液.
-
各取50 μL粪便原液和肠道原液分别加入450 μL磷酸缓冲液(PBS),梯度稀释后得到10-1~10-9稀释度的粪便液和肠道液,取10-3~10-9的稀释液100 μL涂布至LB培养基中,30 ℃培养箱培养24~72 h后挑取不同形态特征的单菌落划线培养,通过多次单菌落划线以获得纯分离株.
-
提取肠道细菌分离株基因组采用方法一:
1) 超净工作台中挑取单菌落至装有50 μL裂解缓冲液的PCR管中;
2) 80 ℃热变性15 min后,低速离心,吸取5 μL裂解后的上清液作为模板;
3) 用细菌通用引物27F和1492R进行PCR扩增,扩增体系如下:模板5 μL,引物27F/1492R各1 μL,1×TaqMaster(purple)43 μL.PCR反应程序为:96 ℃,预变性10 min;96 ℃,变性30 s;55 ℃,退火30 s;72 ℃,延伸1 min 30 s,35个循环;72 ℃,延伸10 min.将PCR产物送至生工生物工程(上海)股份有限公司测序.
用方法一提取部分细菌分离株基因组时,PCR后无法得到有效的扩增产物,则改用基因组提取方法二:
1) 吸1 mL LBG液体培养基于1.5 mL离心管中,挑取单菌落于管中,置于30 ℃摇床培养6 h;
2) 以1 000 r/min的转速离心5 min,收集菌体,弃上清液;
3) 加入500 μL TE25S溶液重悬菌体;
4) 加入10 μL 50 g/L溶菌酶溶液,轻柔混合,37 ℃静置30~60 min;
5) 加入5 μL 20 g/L蛋白酶K,30 μL 10%SDS;
6) 混匀,55 ℃温育60 min(每隔10~15 min取出并上下颠倒混匀一次);
7) 加入100 μL 5 mol/L NaCl,上下颠倒混匀;
8) 加入65 μL CTAB/NaCl混合液(0.7 mol/L NaCl,10%CTAB);
9) 混合均匀后,55 ℃静置10 min;
10) 取出冷却至室温,加入400 μL DNA提取液,震荡混匀5~10 min;
11) 在4 ℃温度下,以12 000 r/min的转速离心10 min;
12) 将上清液转移至新的1.5 mL离心管中,重复几次,直至无白色中间层;
13) 将上清液转移至新的1.5 mL离心管中,加入等体积的异丙醇混合均匀;
14) 在4 ℃温度下,以12 000 r/min的转速离心10 min;
15) 弃去上清液,加入75%乙醇,颠倒混匀,在4 ℃温度下,以12 000 r/min的转速离心10 min,重复一次;
16) 弃去上清液,晾干后加入50~100 μL ddH2O;
17) 用细菌通用引物27F和1492R进行PCR扩增,扩增体系如下:模板5 μL,引物27F/1492R各1 μL,1×TaqMaster(purple)43 μL. PCR反应程序为:96 ℃,预变性10 min;96 ℃,变性30 s;55 ℃,退火30 s;72 ℃,延伸1 min 30 s,35个循环;72 ℃,延伸10 min.将PCR产物送至生工生物工程(上海)股份有限公司测序.
-
将测序结果在NCBI(https://www.ncbi.nlm.nih.gov)中进行序列比对,下载同源性较高的序列,使用MEGA 5.0进行多重序列比对[20],并构建系统发育树进行分析.同时将获得的16S rDNA基因序列在RDP数据库的Classifer程序(https://rdp.cme.msu.edu/classifier/classifier.jsp)进行比对,获得同源性较高序列的相关信息.
1.1. 实验材料
1.2. 实验用的培养基
1.3. 主要试剂
1.4. 草地贪夜蛾幼虫中肠内容物及粪便的收集
1.5. 肠道微生物的分离培养
1.6. 肠道细菌的分子鉴定
1.7. 数据分析
-
本次实验从江津采集的草地贪夜蛾幼虫肠道中分离获得38个分离株,利用细菌通用引物27F/1492R对38个分离株进行PCR扩增测序得到其16S rDNA序列.利用Blastclust对38个测序结果及本课题组先前数据[19]进行同源聚类分析,同源性大于97%为一个聚类单元,共获得20个聚类单元(表 1).
将测序结果在GenBank和RDP两个数据库中比对获得相关信息,比对结果显示在本次从重庆江津高粱地草地贪夜蛾幼虫肠道分离得到38个细菌分离株中,JJSF2-1,JJSF2-2,JJSF2-3,JJSF2-5,JJSF2-15,JJSF2-17,JJSF2-19,JJSF2-24,JJSF2-34,JJSF2-36属于克雷伯氏菌属(Klebsiella);JJSF2-4,JJSF2-27属于肠球菌属(Enterococcus);JJSF2-6,JJSF2-7,JJSF2-33,JJSF2-37属于微球菌属(Micrococcus);JJSF2-8,JJSF2-38属于葡萄球菌属(Staphylococcus);JJSF2-9,JJSF2-10,JJSF2-28属于芽孢杆菌属(Bacillus);JJSF2-11,JJSF2-12,JJSF2-13,JJSF2-14,JJSF2-18,JJSF2-20,JJSF2-21,JJSF2-22,JJSF2-23,JJSF2-26,JJSF2-29,JJSF2-30,JJSF2-32,JJSF2-35属于不动杆菌属(Acinetobacter);JJSF2-16属于寡养单胞菌属(Stenotrophomonas);JJSF2-25属于假单胞菌属(Pseudomonas);JJSF2-31属于鞘脂杆菌属(Sphingobacterium).其中克雷伯氏菌属(Klebsiella)、微球菌属(Micrococcus)、葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)、寡养单胞菌属(Stenotrophomonas)和鞘脂杆菌属(Sphingobacterium)6个属,在前期对采食高粱的草地贪夜蛾幼虫肠道细菌分离实验中未分离到.不动杆菌属(Acinetobacter)的分离株在聚类分析中分为4个聚类单元,克雷伯氏菌属(Klebsiella)、肠球菌属(Enterococcus)、芽孢杆菌属(Bacillus)、微球菌属(Micrococcus)、假单胞菌属(Pseudomonas)和肠杆菌属(Enterobacter)各分为2个聚类单元;其中不动杆菌属(Acinetobacter)丰度最高,其次是克雷伯氏菌属(Klebsiella).在本次从重庆巫山玉米地草地贪夜蛾幼虫肠道分离得到的5个细菌分离株中,WS3-2,WS3-3,WS3-4属于不动杆菌属(Acinetobacter);WS3-1,WS3-5属于类香味菌属(Myroides).其中,类香味菌属(Myroides)在前期对巫山的草地贪夜蛾幼虫肠道细菌分离实验中未分离到.
-
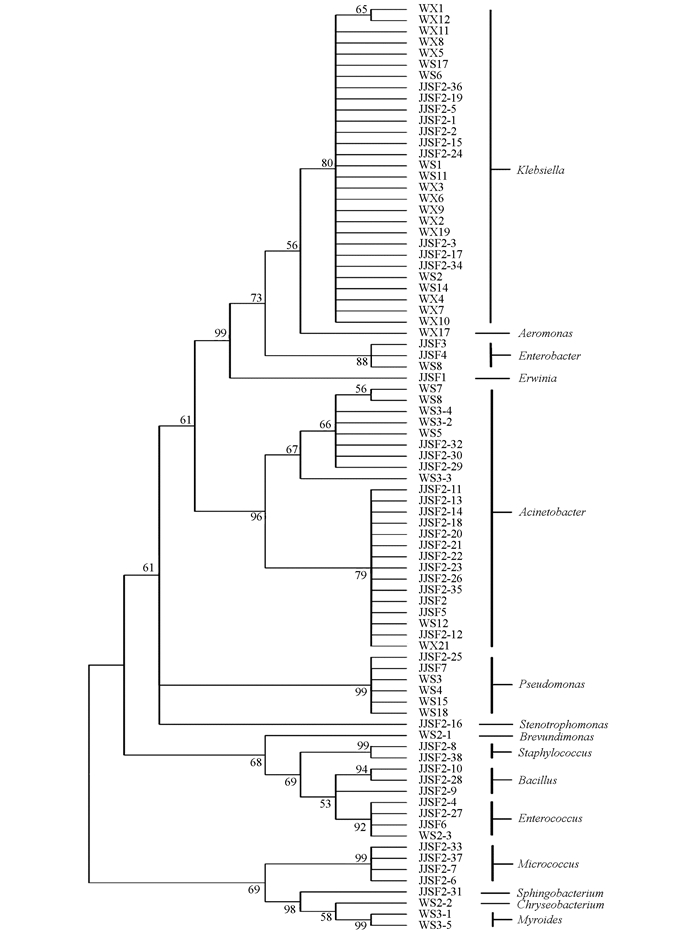
为了探究食物差异对草地贪夜蛾幼虫肠道细菌组成结构的影响,结合课题组前期的数据[17-19],对分离自江津高粱地草地贪夜蛾幼虫肠道的45个分离株和分离自巫山、巫溪玉米地草地贪夜蛾幼虫肠道的38个分离株进行系统发育树分析(图 1).
结果显示克雷伯氏菌属(Klebsiella)和不动杆菌属(Acinetobacter)在江津、巫山以及巫溪的草地贪夜蛾幼虫肠道中广泛存在,分别占所有分离株的34.9%和28.9%.在江津高粱地、巫山以及巫溪玉米地草地贪夜蛾幼虫肠道中都分离到克雷伯氏菌属(Klebsiella)、不动杆菌属(Acinetobacter)、肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)、肠球菌属(Enterococcus)和鞘脂杆菌属(Sphingobacterium);而欧文氏菌属(Erwinia)、寡养单胞菌属(Stenotrophomonas)、葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)和微球菌属(Micrococcus),只在江津高粱地草地贪夜蛾幼虫肠道中分离得到;气单胞菌属(Aeromonas)、短波单胞菌属(Brevundimonas)、金黄杆菌属(Chryseobacterium)和类香味菌属(Myroides)仅在巫山和巫溪玉米地草地贪夜蛾幼虫肠道中分离得到.采食玉米的草地贪夜蛾幼虫肠道中的鞘脂杆菌属(Sphingobacterium)细菌是在后续研究中课题组进一步从巫山草地贪夜蛾幼虫肠道中鉴定到的(数据未发表).比较结果表明草地贪夜蛾幼虫肠道细菌组成在一定程度上受到食物和地域环境的影响,但某些细菌如不动杆菌属(Acinetobacter)和克雷伯氏菌属(Klebsiella)等在草地贪夜蛾幼虫肠道中普遍存在.
2.1. 江津地区高粱地草地贪夜蛾幼虫肠道细菌分子鉴定
2.2. 江津地区以高粱为食的草地贪夜蛾幼虫与巫山、巫溪地区以玉米为食的草地贪夜蛾幼虫肠道细菌比较
-
肠道微生物在宿主的发育、抗性、营养和生理等方面发挥着重要作用,利用肠道细菌来维持肠道稳态和治疗疾病长期以来一直是生物医学的热点,同时肠道细菌在害虫防控方面具有很好的前景[9].在利用昆虫不育技术控制地中海果蝇(Ceratitis capitata)的研究中发现,工厂饲养的γ-辐照不育雄性地中海果蝇在吸引及与野生雌性交配方面能力较弱,通过分析其肠道微生物群的结构发现,在利用γ-辐照使雄性地中海果蝇不育的过程中对其肠道微生物群落结构造成了影响,其中克雷伯氏菌的水平显著降低,潜在致病菌假单胞菌增加.而在辐照后的食物中添加产酸克雷伯氏菌(Klebsiella oxytoca)后,不育雄性地中海果蝇的竞争力显著提高[21].宿主体内的肠道微生物结构受到遗传背景、饮食以及环境等因素的影响,在一项分析3种取食不同寄主植物的植食性叶蜂肠道菌群的研究中发现,3种叶蜂的肠道菌群组成与其各自取食的寄主植物密切相关[22].草地贪夜蛾是一种杂食性害虫,寄主植物广泛,有玉米、水稻、高粱、谷子、甘蔗、小麦、棉花、花生和大豆等,研究取食不同食物的草地贪夜蛾肠道细菌的差异,对研究草地贪夜蛾肠道的核心菌群以及食物对草地贪夜蛾肠道菌群结构的影响提供了基础.
本研究通过纯培养的方法,对来自江津高粱地和巫山玉米地草地贪夜蛾幼虫的肠道细菌进行分离培养并结合16S rDNA进行初步鉴定.在江津高粱地草地贪夜蛾幼虫肠道中新分离鉴定到前期未报道的6个菌属,分别为克雷伯氏菌属(Klebsiella)、微球菌属(Micrococcus)、葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)、寡养单胞菌属(Stenotrophomonas)和鞘脂杆菌属(Sphingobacterium);此外,在巫山玉米地草地贪夜蛾幼虫肠道中进一步分离鉴定到前期未报道的类香味菌属(Myroides).本课题组从草地贪夜蛾幼虫肠道获得的所有分离株中,克雷伯氏菌属(Klebsiella)的比例最高,占所有分离株的34.9%,不动杆菌属(Acinetobacter)其次,占所有分离株的28.9%;克雷伯氏菌属(Klebsiella)在江津高梁地实验组中占22.2%,在巫山及巫溪玉米地组中占50%;不动杆菌属(Acinetobacter)在江津高梁地实验组中占35.6%,在巫山及巫溪玉米地组中占21.1%,推测克雷伯氏菌属(Klebsiella)和不动杆菌属(Acinetobacter)对草地贪夜蛾的生理生化具有重要作用.此外,在高粱地和玉米地草地贪夜蛾肠道中分离的菌株存在差异,只在江津高粱地草地贪夜蛾的幼虫肠道中分离到欧文氏菌属(Erwinia)、寡养单胞菌属(Stenotrophomonas)、葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)和微球菌属(Micrococcus)的菌株,而气单胞菌属(Aeromonas)、短波单胞菌属(Brevundimonas)、金黄杆菌属(Chryseobacterium)和类香味菌属(Myroides)仅分离于巫山及巫溪玉米地草地贪夜蛾的幼虫肠道中.其中气单胞菌属(Aeromonas)仅在巫溪草地贪夜蛾幼虫肠道中分离得到,短波单胞菌属(Brevundimonas)、金黄杆菌属(Chryseobacterium)和类香味菌属(Myroides)仅分离自巫山草地贪夜蛾幼虫肠道,推测是由于食物以及地域生态环境导致的差异.
从采集自同一片江津高粱地的草地贪夜蛾幼虫和玉米黏虫肠道中都分离到克雷伯氏菌属(Klebsiella)、不动杆菌属(Acinetobacter)、肠球菌属(Enterococcus)、芽孢杆菌属(Bacillus)和寡养单胞菌属(Stenotrophomonas)5个属的细菌;而微球菌属(Micrococcus)、欧文氏菌属(Erwinia)、假单胞菌属(Pseudomonas)、葡萄球菌属(Staphylococcus)和鞘脂杆菌属(Sphingobacterium)5个属仅分离于草地贪夜蛾幼虫肠道中,金黄杆菌属(Chryseobacterium)仅分离于玉米黏虫肠道中,虽然生长在同一地区且采食同一物种,但草地贪夜蛾和玉米黏虫肠道细菌组成存在差异,推测是由于宿主特异性或者挑斑鉴定的随机性导致的.
本研究通过纯培养的方法分离获得草地贪夜蛾幼虫的肠道细菌群数据,结合课题组前期的数据[17-19],探究了不同地区取食不同食物的草地贪夜蛾幼虫肠道细菌的差异和同一地区相同食物的草地贪夜蛾幼虫和玉米黏虫肠道细菌的差异.研究结果表明昆虫肠道细菌组成受到食物、环境和物种差异的影响.但本实验采用的培养条件单一,缺乏在微生物的培养基偏好、温度、湿度等生长条件上做更多的探索,这对草地贪夜蛾肠道细菌组成的鉴定造成了影响,因此在后续研究中需要尝试更多的培养条件以拓展纯培养微生物的多样性,并运用组学的方法对不可纯培养的微生物群进行研究.



 下载:
下载: